 |
Главная |
Соли. Группы солей. Получение солей. Свойства солей. Примеры?
|
из
5.00
|
Соли– это сложные вещества, образованные атомами металлов и кислотными остатками.
С точки зрения теории электролитической диссоциации соли - это электролиты, диссоциирующие в водных растворах на катионы металлов и анионы кислотных остатков. Соли бывают средние (нормальные), кислые и основные.
Средние соли – это продукты полного замещения водорода в кислоте на атомы металла или гидроксогруппы ОН- в основании на кислотный остаток. Например: имеем серную кислоту H2SO4. Средние соли этой кислоты будут иметь состав Na2SO4, CaSO4, Al2(SO4)3. Средние соли ортофосфорной кислоты H3PO4: К3PO4, Ca3(PO4)2, AlPO4. Средние соли в водных растворах диссоциируют всегда в одну ступень: NaCI ® Na+ + CI - Al2(SO4)3 ® 2AI3+ + 3SO42-.
Кислые соли можно рассматривать как продукты неполного замещения атомов водорода кислоты на атомы металлов. Кислые соли могут быть образованы только от многоосновных кислот. Хлороводородная кислота HCl кислых солей не имеет. Серная кислота H2SO4 образует кислые соли в состав которых входит анион HSO4-: NaHSO4, Cu(HSO4)2, Fe(HSO4)3. Фосфорная кислота Н3РО4 имеет два типа кислых солей: с анионами Н2РО4-, НРО42-. Кислые соли диссоциируют ступенчато: KH2PO4 ® K+ + H2PO4-, H2PO4-  H+ + HPO42-, HPO42-
H+ + HPO42-, HPO42-  H+ + PO43-,
H+ + PO43-,
Кислые соли чаще всего образуются в избытке кислоты: Mg(OH)2 + 2H2SO4  Mg(HSO4)2 + 2H2O - кислая соль
Mg(HSO4)2 + 2H2O - кислая соль
Mg(OH)2 + H2SO4  MgSO4 + 2H2O - средняя соль
MgSO4 + 2H2O - средняя соль
Основные соли можно рассматривать как продукты неполного замещения ионов ОН- основания на ионы кислотных остатков. Они могут быть образованы только многокислотными основаниями. Гидроксиды щелочных металлов основных солей не имеют. Гидроксиду меди Сu(ОН)2 соответствуют основные соли с катионом СuОН+: CuOHNO3, (CuOH)2SO4, (CuOH)3PO4. Гидроксид хрома (III) Cr(ОН)3 образует два ряда основных солей с катионами Cr(ОН)2+, CrОН2+: Cr(OH)2CI, CrOHCI2, (Cr(OH)2)2SO4, CrOHSO4, (Cr(OH)2)3PO4, (CrOH)3(PO4)2. Основные соли диссоциируют ступенчато: CuOHNO3 ® CuOH+ + NO3- (первая ступень), CuOH+  Cu2+ + OH- (вторая ступень).
Cu2+ + OH- (вторая ступень).
Основные соли образуются в избытке основания: 2Cu(OH)2 + H2SO4  (CuOH)2SO4 + 2H2O основная соль
(CuOH)2SO4 + 2H2O основная соль
Cu(OH)2 + H2SO4  CuSO4 + 2H2O средняя соль
CuSO4 + 2H2O средняя соль
Классификация солей по следующим признакам:
1. По растворимости: растворимые–KCI, Ba(NO3)2, CuSO4, нерастворимые–BaSO4, AgCI, Ca3(PO4)2.
2.По свойствам: cредние или нормальные– Na2SO4, MgCI2, кислые – KHSO4, Ca(H2PO4)2, основные – CuOHCI, AI(OH)2NO3.
Получение
1. Взаимодействие металла с неметаллом: Fe + S  FeS.
FeS.
2. Взаимодействие металлов, расположенных в ряду напряжений левее водорода, с растворами кислот:
Zn + H2SO4  ZnSO4 + H2
ZnSO4 + H2 
3. Взаимодействие металлов с растворами солей: Fe + CuSO4  FeSO4 + Cu.
FeSO4 + Cu.
4. Взаимодействие кислот с основаниями (реакция нейтрализации): HCI + NaOH  NaCI + H2O.
NaCI + H2O.
5. Взаимодействие кислот с основными оксидами: H2SO4 + CaO  CaSO4 + H2O.
CaSO4 + H2O.
6. Взаимодействие кислот с растворами солей: H2SO4 + BaCI2  BaSO4
BaSO4  + 2HCI.
+ 2HCI.
7. Взаимодействие оснований с растворами солей: 2NaOH + CuSO4  Cu(OH)2
Cu(OH)2  + Na2SO4.
+ Na2SO4.
8. Взаимодействие оснований с кислотными оксидами: Ca(OH)2 + CO2  CaCO3
CaCO3  + H2O.
+ H2O.
9. Взаимодействие основных оксидов с кислотами: CaO + CO2  CaCO3
CaCO3 
10. Взаимодействие растворов солей с неметаллами: 2KBr + CI2  2KCI + Br2.
2KCI + Br2.
11. Взаимодействие растворов солей между собой: NaCI + AgNO3  AgCI
AgCI  + NaNO3.
+ NaNO3.
12. Получение солей аммония: NH3 + HCI  NH4CI.
NH4CI.
Химические свойства
1. Растворы солей взаимодействуют с металлами, расположенными в ряду напряжений левее, чем металл, входящий в состав соли: Zn + FeSO4  ZnSO4 + Fe.
ZnSO4 + Fe.
2.Растворимые в воде соли взаимодействуют с основаниями: CuSO4 + 2NaOH  Cu(OH)2
Cu(OH)2  + Na2SO4,
+ Na2SO4,
3. Соли взаимодействуют с растворами кислот: CaCI2 + H2SO4  CaSO4
CaSO4  + 2HCI, Ca(HCO3)2 + 2HCI
+ 2HCI, Ca(HCO3)2 + 2HCI  CaCI2 + H2O + CO2
CaCI2 + H2O + CO2 
4.Водные растворы солей взаимодействуют между собой с образованием новых солей: BaCI2 + Na2SO4  BaSO4
BaSO4  + 2NaCI,
+ 2NaCI,
5. Растворы солей взаимодействуют с неметаллами: 2NaI + Br2  2NaBr + I2
2NaBr + I2 
6. Многие соли при нагревании разлагаются, особенно легко – карбонаты: CaCO3 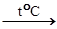 CaO + CO2
CaO + CO2 
7. Некоторые соли взаимодействуют с водой с образованием кристаллогидратов: CuSO4 + 5H2O ® CuSO4 . 5 Н2О.
белый цвет голубой цвет
|
из
5.00
|
Обсуждение в статье: Соли. Группы солей. Получение солей. Свойства солей. Примеры? |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

