 |
Главная |
Регуляция синтеза жирных кислот
|
из
5.00
|
Регуляторный фермент синтеза жирных кислот - ацетил-КоА-карбоксилаза. Этот фермент регулируется несколькими способами.
Ассоциация/диссоциация комплексов субъединиц фермента. В неактивной форме ацетил-КоА-карбоксилаза представляет собой отдельные комплексы, каждый из которых состоит из 4 субъединиц. Активатор фермента - цитрат; он стимулирует объединение комплексов, в результате чего активность фермента увеличивается. Ингибитор - пальмитоил-КоА; он вызывает диссоциацию комплекса и снижение активности фермента .
Фосфорилирование/дефосфорилирование ацетил-КоА-карбоксилазы. В постабсорбтивном состоянии или при физической работе глюкагон или адреналин через аденилатциклазную систему активируют протеинкиназу А и стимулируют фосфорилирование субъединиц ацетил-КоА карбоксилазы. Фосфорилированный фермент неактивен, и синтез жирных кислот останавливается. В абсорбтивный период инсулин активирует фосфатазу, и ацетил-КоА карбоксилаза переходит в дефосфорилированное состояние (рис. 8-41). Затем под действием цитрата происходит полимеризация протомеров фермента, и он становится активным. Кроме активации фермента, цитрат выполняет и другую функцию в синтезе жирных кислот. В аб-сорбтивный период в митохондриях клеток печени накапливается цитрат, в составе которого остаток ацетила транспортируется в цитозоль.
Индукция синтеза ферментов. Длительное потребление богатой углеводами и бедной жирами пищи приводит к увеличению секреции инсулина, который стимулирует индукцию синтеза ферментов: ацетил-КоА-карбоксилазы, синтазы жирных кислот, цитратлиазы, изоцитратдегидрогеназы. Следовательно, избыточное потребление углеводов приводит к ускорению превращения продуктов катаболизма глюкозы в жиры. Голодание или богатая жирами пища приводит к снижению синтеза ферментов и, соответственно, жиров.
43.Транспорт ацетилСоА из митохондрий в цитоплазму. В матриксе митохондрий основное количество ацетил-СоА обр-ся при окислительном декарбоксилировании пирувата, в процессе β-окисления жирных кислот, при расщеплении углеродных скелетов аминокислот.
Ацетил-СоА является заряженной молекулой, поэтому он не способен преодолеть внутреннюю мембрану митохондрий. Для транспорта ацетильных групп в цитоплазму сущ-ет специальный «челночный механизм». Им является цитрат- малат-пируватный транспортер
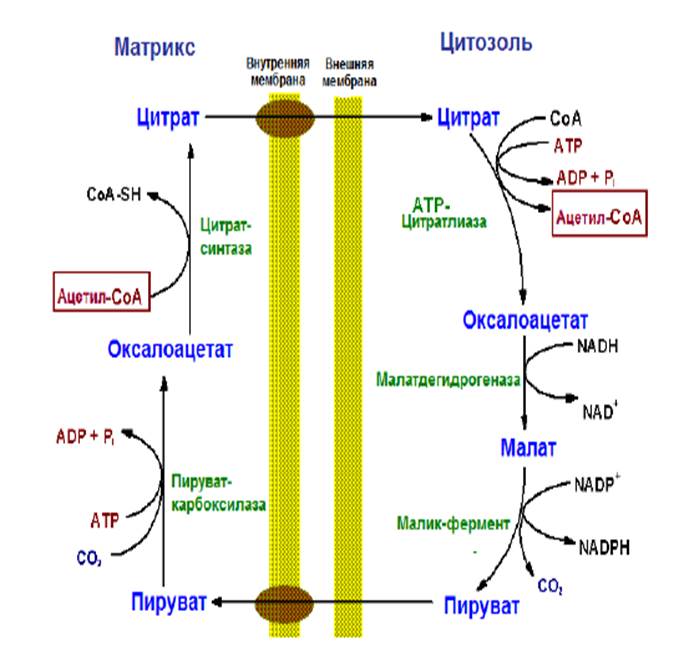
Рис. Транспорт ацетил-СоА из матрикса митохондрий в цитозоль
Ацетильные компоненты попадают в цитоплазму в составе цитрата, который при участии АТР-цитрат-лиазы расщепляется на оксалоацетат и ацетил-СоА. Для реакции необходимы АТР и HSCоА.
Оксалоацетат восстанавливается в малат и таким образом возвращается в матрикс, где регенерируется в цитрат.
Часть малата под действием малик-фермента (NADP+-зависимой малатдегидрогеназы) подвергается окислительному декарбоксилированию с образованием пирувата и NADPH.
NADPH используется в качестве восстановительного эквивалента в липогенезе.
Пируват транспортируется в митохондрии.
Транспорт цитрата из митохондрий в цитозоль происходит при высокой концентрации кислоты. Это наблюдается тогда, когда изоцитратдегидрогеназа ингибируется высокими концентрациями АТР.
При повышении концентрации цитрата в митохондриях начинает работать «челночный механизм» − цитрат поступает в цитозоль.
Появление его в цитозоле служит аллостерическим сигналом о том, что цикл лимонной кислоты перегружен топливом и что избыток ацетил-СоА должен запасаться в виде триацилглицеролов.
44.Локализация пунктов сопряжения окисления и фосфорилирования. Значение ступенчатого транспорта электронов. При переносе водорода на кислород каждая пара элект-в, акцептируемых от субстрата, трижды пересекает мем-ну и каждый раз выводит пару протонов.
Первый переход совершается через восстановленный FMNH2. Вернувшись на внутреннюю поверхность мембраны с помощью железосерных белков, электроны переходят на 2 молекулы убихинона, каждая из которых при этом захватывает протон из внутренней среды, образуя гидрохинон.
С его помощью электроны вновь выходят наружу и возвращаются при участии цитохромов.
На внутренней стороне мембраны электроны восстанавливают еще одну пару молекул убихинона и мигрируют наружу в третий раз.
Возвращаются во внутреннюю среду через систему цитохромов (с1, с, а, а3) и переходят на кислород.
На каждом участке дыхательной цепи, где изменение окислительно-восстановительного потенциала оказывается достаточным для образования необходимой протон-движущей силы (эта разность ΔЕ≈0,25 В), может синтезироваться АТР.
В дыхательной цепи имеется 3 пункта сопряжения окисления и фосфорилирования: между NADH и CоQН2 (ΔЕ′o≈0,3 В),
между CоQН2 и цитохромом с1 (ΔЕ′o≈0,21 В) и
между цитохромом а и цитохромом а3 (ΔЕ′o≈0,53 В).
Общая разница потенциалов между NADH и кислородом соста-ет около 1,2 В, а суммарный электронный ток на внутрикле-х мем-ах у ч-ка в состоянии покоя около 100 А, мощность аэробного оттока энергии равна 120 Вт.
Действие ингибиторов выражается в препятствовании окислению субстратов, чем сокращается выделение водорода в дыхательную цепь.
Тяжелые металлы и мышьяк ( III) блокируют SH-группы дегидрогеназ.
Ротенон и амитал (ингибиторы комплекса I) блокируют образование протонного потенциала: прерывают поступление водорода от NADH.
Антимицин А типичный ингибитор комплекса bc1 подавляет циклический перенос электронов.
Цианиды, азиды, СО ингибируют цитохромоксидазу, блокируя передачу водорода на кислород. В результате возникает ситуация кислородного голодания, хотя кислород имеется в избытке.
Выключается протонный градиент и связанное с ним фосфорилирование. Наступает энергетический голод и прекращается жизнедеятельность.
45.Окислительное фосфорилирование в дыхательной цепи. Хемиосмо-ая теория Митчелла. Окисление, сопряженное с синтезом АТР, называется сопряженным окислением, которое может осуществляться двумя путями: на уровне субстрата и на уровне электронтранспортной цепи.
В ходе реакций окисления электроны, находящиеся на высокоэнергетическом уровне в молекуле восстановителя (водорода), переходят на низкоэнергетическую орбиталь в молекуле окислителя, где они сильнее притягиваются ядрами атомов.
Способность молекулы принимать электроны оценивается по величине окислительно-восстановительного потенциала (Е).
Отрицательная величина Е обозначает низкое сродство, положительная – высокое сродство.В биологии используется стандартный Е′0 (нормальный потенциал), определяемый при параметрах 25°С, 1 моль/л, 1 атм, рН=7,0.
В процессе окисления перенос электронов происходит по направлению от более отрицательного к более положительному потенциалу. Электроны при отрицательном значении потенциала являются «высокоэнергетическими» и при переходе к системе с более высоким значением потенциала они теряют часть своей энергии и способны произвести работу.
Например, сопряженным окислением на уровне субстрата являются реакции окисления 3-фосфоглицеринового альдегида в 1,3-дифосфоглицерат, 2-фосфоглицерата – в 2-фосфоенолпируват (реакции гликолиза).
С возникающих в ходе этих реакций соединений фосфат, связанный макроэргической связью, легко передается на ADP.
Однако посредством реакций субстратного фосфорилирования образуется сравнительно небольшое количество АТР.
Наиболее прост механизм образования АТР при окислении 2-фосфоглицерата.
Эта реа-я, катализируемая енолазой, предс-ет собой внутримоле-ое окисление, в р-те к-го обр-ется богатое энергией фосфорное соед-ие – фосфоенолпируват. Окисление ведет к уменьшению плотности электронов на атоме фосфора в молекуле фосфоенолпирувата. Это придает фосфорильному остатку способность взаимодей-ать с молекулой ADP, что приводит к синтезу АТР. В данной реакции функции донора электронов, акцептора электронов и акцептора энергии окисления выполняют различные атомарные группировки в молекуле одного и того же вещества – 2-фосфоглицерата.
В роли первичного макроэргического соединения, аккумулирующего энергию окисления, выступает один из продуктов реакции – фосфоенолпируват.
Фосфорилирование при анаэробном окислении глицеральдегид-3-фосфата происходит более сложным путем.
Окисление субстрата яв. р-том взаимоде-ия с комплексом фермент-NAD.
Вначале альдегид-ферментный комплекс окисляется до ацилфермента, а затем под действием неорганического фосфата тиоловый эфир расщепляется с образованием макроэргического соединения 1,3-дифосфоглицерата. В последующем под действием фермента фосфоглицераткиназы макроэргическая фосфатная группа этого соединения переносится на ADP с образованием АТР. В роли донора электронов в этой реакции выступает глицеральдегид-3-фосфат, вступающий в соединение с ферментом.
Роль акцептора электронов выполняет NAD+, в качестве компонента сопряжения выступает SH-группа фермента, первичное высокоэнергетическое соединение представлено ацил-ферментом.
Энергет-ое сост-ие клетки можно оценить с помощью энергетич-го заряда.
Если все соде-иеся в клетке аденозинфосфаты на-ятся в форме АТР, это озна-чает, что сис-ма энергет-ки заполнена до предела, т.е. ее энер-ий заряд = 1,0.
Когда все содержащиеся в клетке аденозинфосфаты находятся в форме АМР. В этом случае система не содержит высокоэнергетических связей, т.е. она энергетически «пуста» и ее энергетический заряд равен 0.
Если все аденозинфосфаты находятся в форме ADP или эквимолярной смеси АТР и АМР, это значит, что система заполнена высокоэнергетическими связями наполовину, т.е. ее энергетический заряд равен 0,5.
Энергетический заряд системы АТР, ADP, АМР можно вычислить для любого соотношения концентраций АТР, ADP и АМР при помощи уравнения.
Хемиосмотическая теория Митчелла.Согласно хемиос-ой теории П. Митчелла, сопряжение тканевого дыхания с окислительным фосфорилированием обеспе-ется внутренней митохондриальной мембраной, целостность которой обуславливает возникновение движущей силы синтеза АТР-протонного потенциала. В р-те происходит перекачивание протонов из матрикса на цитоплазматическую поверхность и создается градиент рН. Движение протонов в обратном направлении (по каналу фактора Fo) ведет к активации АТР-синтазы (фактор F) и синтезу АТР из АDP и фосфата. Транспорт АТР из матрикса в цитоплазму осуще-ется переносчиком – транслоказой. Фермент катали-ет перенос одной молекулы АТР из матрикса в обмен на одну молекулу АDP, переносимую в матрикс.Нарушение транспорта АDP или фосфата приводит к торможению синтеза АТP. Гипотеза П. Митчелла требует соблюдения условий: 1) внутренняя митохондриальная мембрана должна быть интактна и непроницаема для протонов, направляющихся снаружи внутрь; 2) в результате активности дыхательной цепи ионы водорода поступают в нее изнутри, из матрикса, а освобождаются на наружной стороне мембраны; 3) движение ионов водорода, направленное изнутри наружу должно приводить к их накоплению, вследствие чего между двумя сторонами митохондриальной мембраны возникает градиент рН; 4) необходимы затраты энергии, которая поставляется при переносе электронов по электронтранспортной цепи; 5) синтез АТР поддерживать наличием электрохимического градиента.
46.Строение АТР-синтазного комплекса. Механизм образования АТР. АТР-синтазный комплекс (Н+-АТРаза) – обратимый фермент, обладающий как АТР-синтазной, так и АТРазной активностью.
Синтез АТР осуществляется за счет протонного градиента ΔμН+, а гидролиз АТР приводит к тому, что протонная АТРаза сопряженно генерирует трансмембранную разность электрохимического потенциала Н+.
В Н+-АТРазе происходят процессы по общей схеме: 
АТР-синтазный комплекс (F0F1-АТРаза) состоит из растворимой АТР-синтазы (фактор F1) и мембранных компонентов (комплекс F0)
Комплекс F1 может поворачиваться вокруг оси.Вращение и конформационные перестройки комплекса F1 переводят этот центр в состояние 2.
В состоянии 2 в каталитическом центре самопроизвольно идет образование и разрыв ковалентной связи АDP-P, поскольку константа равновесия АТP↔АDP+Pi близка к единице.
F0 формирует канал, по которому протоны поступают к активному центру АТРазы.
Механизм образования АТPСогласно хемиосмотическому механизму захват энергии, выделяющейся в процессах электронного транспорта, осуществляется за счет создания трансмембранной разности ΔμН+, а перенос энергии к АТP-синтазе обеспечивается потоком протонов через ее протонный канал.
Синтез АТР из АDP и Рi может происходить и в отсутствие переносчиков электронов.
Необходима разность электрохимических потенциалов Н+ на мембране, в которой находится АТР-синтаза.
Хемиосмотический принцип трансформации энергии не может объяснить непосредственного молекулярного механизма синтеза АТР.
На стадиях взаимодействия субстрата и фермента при образовании активной конфигурации и затем при отщеплении образовавшегося продукта в ферменте происходят конформационные изменения.
Такие внешние факторы, как температура, ионная сила раствора, вязкость, могут влиять на эти релаксационные стадии.
Непосредственный акт катализа в сформированной активной конфигурации уже не требует тепловой энергии активации.
Элементарное образование АТР может происходить в активном центре Н+-АТР-синтазы в условиях деэнергизации мембраны, когда ΔμН=0, и даже в активном центре изолированного фактора F1, находящегося в растворе.
Однако валового синтеза АТР при этом не происходит.
При энергизации мембраны за счет увеличения ΔμН процесс ускоряется в 1000 раз.
Энергия ΔμН используется в основном для вытеснения прочно связанного АТР из каталитического центра.
Энергия также затрачивается на связывание фосфата и АDP с ферментом.
47.Челночные механизмы транспорта цитоплазматического NADH в митохондрии. Молекулы цитоплазматического NADН не способны сами проникать через мембрану внутрь митохондрий. Отдаваемые ими электроны могут включаться в митохондриальную цепь биол-го окис-ия с помощью двух челночных механизмов. Глицеролфосфатный челночный механизм Цитоплазматический NADН сначала реагирует с цитоплазматическим дигидроксиацетонфосфатом, образуя глицерол-3-фосфат.
Реакция катализируется NAD-зависимой цитоплазматической глицерол-3-фосфат-дегидрогеназой:
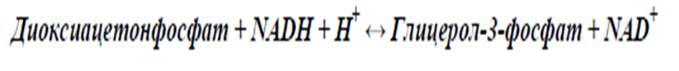
Образовавшийся глицерол-3-фосфат проникает через митохондриал-ю мембрану. Внутри митохондрии другая (митохондриальная) глицерол-3-фосфат-дегидрогеназа (флавиновый фермент) вновь окисляет глицерол-3-фосфат до диоксиацетонфосфата:

На уровне СoQ восстановленный флавопротеин (фермент-FADН2) вводит приобретенные им электроны в цепь биологического окисления и сопряженного с ним окислительного фосфорилирования, а диоксиацетонфосфат выходит из митохондрий в цитоплазму и может вновь взаимодействовать с цитоплазматическим NADH + Н+. Т. о., пара электронов (из одной молекулы цитоплазматического NADH + Н+), вводимая в дыхательную цепь с помощью глицеролфосфатного челночного механизма, дает не три, а две молекулы АТР.
Показано, что с помощью глицеролфосфатного челночного механизма лишь в скелетных мышцах и мозге осуществляется перенос восстановленных эквивалентов от цитозольного NADН + Н+ в митохондрии.
В клетках печени, почек и сердца действует более сложный малат-аспартатный челночный механизм
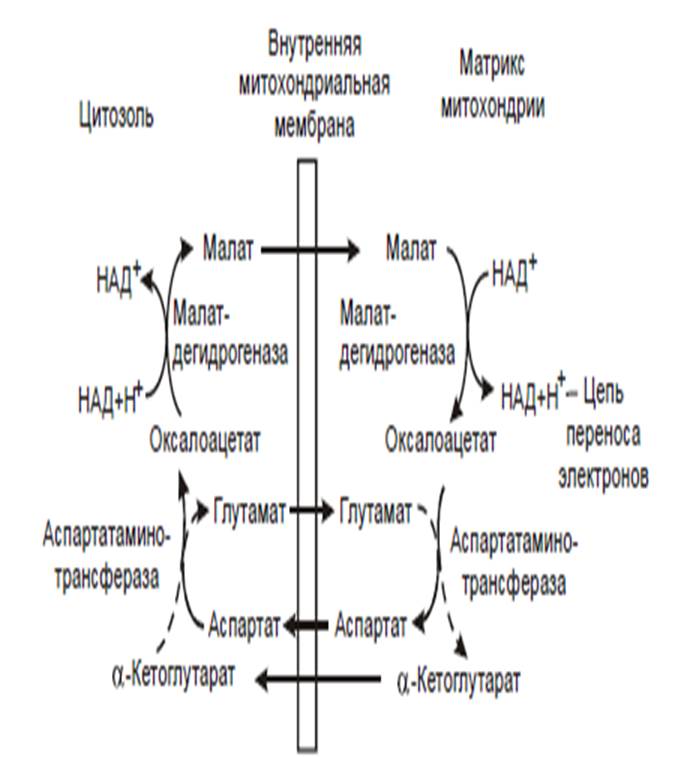
Действие такого челночного механизма становится возможным благодаря присутствию малатдегидрогеназы и аспартатаминотрансферазы как в цитозоле, так и в митохондриях.
От цитозольного NADН+Н+ восстановленные эквиваленты сначала при участии фермента малатдегидрогеназы переносятся на цитозольный оксалоацетат. Образуется малат – с помощью системы, транспортирующей дикарбоновые кислоты, проходит через внутреннюю мембрану митохондрии в матрикс. Малат окисляется в оксалоацетат, а матриксный NAD+ восстанавливается в NADН + Н+, который может теперь передавать свои электроны в цепь дыхательных ферментов, локализованную на внутренней мембране митохондрии.
Образовавшийся оксалоацетат в присутствии глутамата и фермента аспартатаминотрансферазы вступает в реакцию трансаминирования. Образующиеся аспартат и α-кетоглутарат с помощью специальных транспортных систем способны проходить через мембрану митохондрий . В цитозоле транспортир-ие регенерирует оксалоацетат, что вызывает к действию след-ий цикл. В целом процесс включает легкообратимые реакции, происходит без потребления энергии, его «движущей силой» является постоянное восстановление в цитозоле NAD+ глицеральдегид-3-фосфатом, образующимся при катаболизме глюкозы.
При функционировании малат-аспартатного механизма в результате полного окисления одной молекулы глюкозы может образоваться не 36, а 38 молекул АТР.
|
из
5.00
|
Обсуждение в статье: Регуляция синтеза жирных кислот |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

