 |
Главная |
Энергетический эффект цикла Кребса
|
из
5.00
|
В процессе окисления ацетил-КоА образуется три НАДН + Н+ , которые в результате сопряжённого окислительного фосфорилирования образуют по 3 молекулы АТФ каждый, и всего 9 АТФ.
Сукцинатдегидрогеназа Е-ФАДН2, попадая в систему транспорта электронов через КоQ, образует 2 АТФ. В цикле Кребса за счет субстратного фосфорилирования синтезируется одна молекула ГТФ, которая равнозначна одной молекуле АТФ.
Т. образом, при окислении одной молекулы ацетил-КоА в цикле Кребса в сопряжении с окислительным фосфорилированием может образоваться 12 молекул АТФ. Расчёт энергетического эффекта полного распада глюкозы до СО2 и Н2О можно представить в следующей форме:
 Энергетический эффект полного распада одной молекулы глюкозы равен 38АТФ (8АТФ + 6АТФ + 24АТФ).
Энергетический эффект полного распада одной молекулы глюкозы равен 38АТФ (8АТФ + 6АТФ + 24АТФ).
37.Биосинтез гликогена. Роль UDP-Glc в этом процессе. Регу-я на уровне гликогенсинтазы. Гликоген является запасной формой углеводов в организме животных, синт-ся главным образом в печени и составляет до 6% от её массы. В скелетных мышцах его масса не превышает 1%. Синтез гликогена начинается с затраты молекулы АТФ для фосфорилирования глюкозыс обр-ем глюкозо-6-фосфата. Фосфорилирование свободной глюкозы в мышцах идет при участии фермента гексокиназы, а в печени – глюкокиназы. Следующая реакция изомеризации глюкозо-6-фосфатав глюкозо-1-фосфат катализируется ферментом фосфоглюкомутазой. Именно в таком виде глюкоза вовлекается в дальнейший синтез гликогена.

Т.к. фосфоглюкомутазная реакция обратима и чтобы синтез гликогена был термодинамически необратим, необходима дополнительная стадия образования уридиндифосфатглюкозы (УДФ-глюкозы) из УТФ и глюкозо-1-фосфата под контролем фермента UDP -глюкопирофосфорилазы. Реакция сдвинута вправо, так как образовавшийся в ходе реакции пирофосфат очень быстро расщ-ется пирофосфатазой на две мол-лы фосфата. Образование УДФ-глюкозы обеспечивает невозможность протекания распада гликогена путем обратных реакций синтеза этого гомополисахарида.

На второй стадии – стадии образования гликогена – происходит перенос глюкозного остатка , входящего в состав УДФ-глюкозы, на глюкозидную цепь гликогена («затравочное» количество).
При этом обр-ся α-(1–>4)-связь между 1-ым атомом углерода добавляемого остатка глюкозы и 4-гидроксильной группой остатка глюкозы цепи.
Эта реакция катализируется ферментом гликогенсинтазой. Реакция, катализируемая гликогенсинтазой, возможна только при условии, что полисахаридная цепь уже содержит более 4 остатков D-глюкозы. Образующийся УДФ затем вновь фосфорилируется в УТФ за счет АТФ, и т. образом весь цикл превращений глюкозо-1-фосфата начинается сначала.
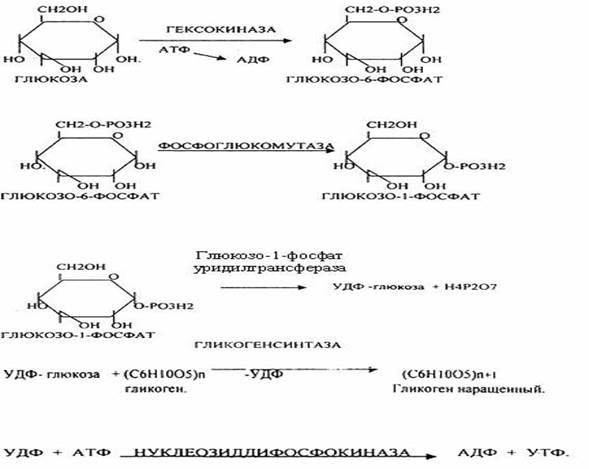 Гликогенсинтаза неспособна катализировать образование α-(1–>6)-связи, имеющейся в точках ветвления гликогена . Этот процесс катализирует гликогенветвящий фермент, или амило-(1–>4)–>(1–>6)-трансглюкозидаза. Катализирует перенос концевого олигосахаридного фрагмента, состоящего из 6 или 7 остатков глюкозы, с нередуцирующего конца одной из боковых цепей, насчитывающей не менее 11 остатков, на 6-гидроксильную группу остатка глюкозы той же или другой цепи гликогена.
Гликогенсинтаза неспособна катализировать образование α-(1–>6)-связи, имеющейся в точках ветвления гликогена . Этот процесс катализирует гликогенветвящий фермент, или амило-(1–>4)–>(1–>6)-трансглюкозидаза. Катализирует перенос концевого олигосахаридного фрагмента, состоящего из 6 или 7 остатков глюкозы, с нередуцирующего конца одной из боковых цепей, насчитывающей не менее 11 остатков, на 6-гидроксильную группу остатка глюкозы той же или другой цепи гликогена.
В р-те обр-ся новая боковая цепь. Ветвление повышает растворимость гликогена. Ветвление увеличивает скорость синтеза и расщепления гликогена.
Переключение процессов синтеза и распада гликогена в печени находится под контролем гормонов поджелудочной железы – инсулина и глюкогона и гормона, вырабатываемого клетками мозгового вещества надпочечников – адреналина, в мышцах инсулином и адреналином, в мозге – адреналином.
38.Пентозофосфатный путь окисления глюкозы.
Служит альтернативным путём окисления глюкозо-6-фосфата.
Путь прямого окисления глюкозы, который связан с образованием восстановленного НАДФН+Н+ , называется пентозофосфатным путем.
Путь прямого окисления углеводов протекает в цитозоле.
Активность пентозофосфатного пути находится на низком уровне в скелетной мышце и на высоком уровне в жировой ткани.
У млекопитающих активность пентозофосфатного пути высока в печени, надпочечниках, эмбриональной ткани и молочной железе в период лактации.

Пентозофосфатный цикл начинается с окисления глюкозо-6-фосфата и последующего окислительного декарбоксилирования продукта (в результате от гексозофосфата отщепляется первый атом углерода). Это первая, так называемая окислительная, стадия пентозофосфатного цикла.
Вторая стадия включает неокислительные превращения пентозофосфатов с образованием исходного глюкозо-6-фосфата
Первая реакция – дегидрирование глюкозо-6-фосфата при участии фермента глюкозо-6-фосфатдегидрогеназы (Г6ФДГ) и кофермента NADP+.
Образовавшийся в ходе реакции 6-фосфоглюконо-δ- лактон – соединение нестабильное и с большой скоростью гидролизуется либо спонтанно, либо с помощью фермента 6-D-фосфоглюконолактоназы с образованием 6-фосфоглюконовой кислоты (6-фосфоглюконат):
Во второй окислительной реакции, катализируемой 6- фосфоглюконат-дегидрогеназой (декарбоксилирующей), 6-фосфоглюконат дегидрируется и декарбоксилируется. В результате образуется фосфорилированная кетопентоза D-рибулозо-5-фосфат и еще 1 молекула NADPH:
Под действием соответствующей эпимеразы из рибулозо-5-фосфата может образоваться другая фосфопентоза ксилулозо-5-фосфат. Кроме того, рибулозо-5-фосфат под влиянием особой изомеразы легко превращается в рибозо-5-фосфат. Между этими формами пентозофосфатов устанавливается состояние подвижного равновесия:
При определенных условиях пентозофосфатный путь на этом этапе может быть завершен.
При других условиях наступает неокислительный этап пентозофосфатного цикла. Реакции этого этапа не связаны с использованием кислорода и протекают в анаэробных условиях.
Частично образуются вещества, характерные для первой стадии гликолиза (фруктозо-6-фосфат, фруктозо-l,6-бисфосфат, фосфотриозы), а частично – специфические для пентозофосфатного пути (седогептулозо-7-фосфат, пентозо-5-фосфаты, эритрозо-4-фосфат).
Основными реакциями неокислительной стадии пентозофосфатного цикла являются транскетолазная и трансальдолазная.
Эти реакции катализируют превращение изомерных пентозо-5-фосфатов
Коферментом в транскетолазной реакции служит тиаминпирофосфат, играющий роль промежуточного переносчика гликольальдегидной группы от ксилулозо-5-фосфата к рибозо-5-фосфату. В результате образуется семиуглеродный моносахарид седогептулозо-7-фосфат и глицеральдегид-3-фосфат.
Транскетолазная реакция в пентозном цикле встречается дважды (второй раз – при образовании фруктозо-6-фосфата и триозофосфата в результате взаимодействия второй мол-лы ксилулозо-5-фосфата с эритрозо-4-фосфатом):
Фермент трансальдолаза катализирует перенос остатка диоксиацетона (но не свободного диоксиацетона) от седогептулозо-7-фосфата на глицеральдегид-3-фосфат:
Шесть молекул глюкозо-6-фосфата, вступая в пентозофосфатный цикл, образуют 6 молекул рибулозо-5-фосфата и 6 молекул СО2, после чего из шести молекул рибулозо-5-фосфата снова регенерируется пять молекул глюкозо-6-фосфата

Основное значение пентозофосфатного пути: поставляет восстановленный НАДФН+Н+ для биосинтеза жирных кислот, холестерина, стероидов, гормонов и т.д.; поставляет пентозофосфаты для синтеза нуклеиновых кислот и многих коферментов; в “аварийных” ситуациях может использоваться как источник энергии; Потребность организма в НАДФН+Н+ покрывается на 50% за счет пентозофосфатного цикла.
39.Пути катаболизма галактозы и фруктозы. Метаболизм фруктозы и галактозы включает пути исп-ия их для синтеза других в-в (гетерополисахаридов, лактозы и др.) и участие в энергообеспечении орг-ма. В последнем случае фруктоза и галактоза превращаются в печени либо в глюкозу, либо в промежуточные продукты её метаболизма. Таким образом, в результате фруктоза и галактоза наряду с глюкозой могут быть окислены до СО2 и Н2О или использованы на синтез гликогена и триацилглицеролов. Причиной нарушения метаболизма фруктозы и галактозы может быть дефект ферментов, катализирующих промежуточные реакции их обмена. Метаболизм фруктозы Значит-ое кол-во фруктозы, образующееся при расще-ии сахарозы, прежде чем поступить в систему воротной вены, превр-ся в глюкозу уже в клетках кишечника. Другая часть фруктозы всасывается с помощью белка-переносчика, т.е. путём облегчённой диффузии.
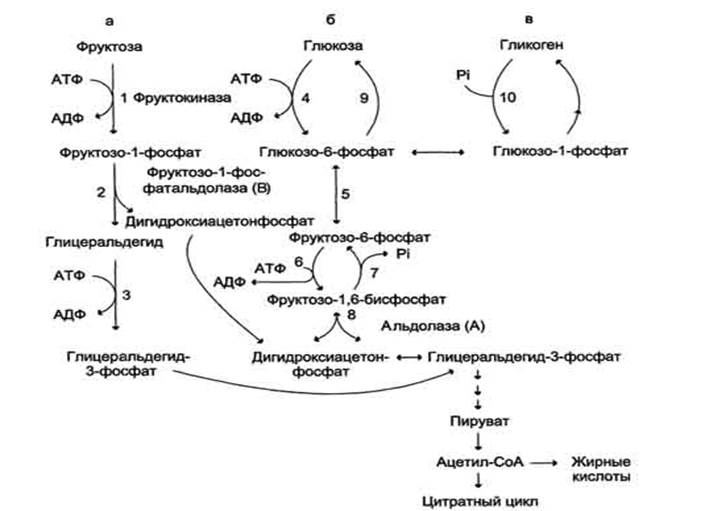
Метаболизм фруктозы. а - превращение фруктозы в дигидроксиацетон-3-фосфат и глицеральдегид-3-фосфат; б - путь включения фруктозы в гликолиз и глюконеогенез; в - путь включения фруктозы в синтез гликогена.
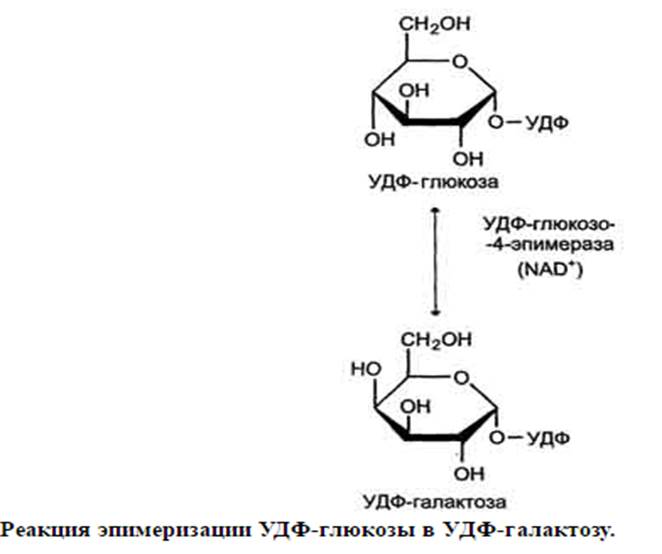
Метаболизм фруктозы начинается с реакции фосфорилирования (реакция 1), катализируемой фруктокиназой с образованием фруктозо-1-фосфата (фермент обнаружен в печени, а также в почках и кишечнике). Фруктозо-1-фосфат далее расщепляется фруктозо-1-фосфатальдолазой (альдолаза В) на глицеральдегид и дигидроксиацетон-3-фосфат (реакция 2). Дигидроксиацетон-3-фосфат является промежуточным продуктом гликолиза и образуется в ходе реакции, катализируемой фруктозо-1,6-бисфосфосфатальдолазой (альдолаза А). Глицеральдегид может включаться в гликолиз после его фосфорилирования с участием АТФ (реакция 3). Две молекулы триозофосфатов либо распадаются по гликолитическому пути, либо конденсируются с образованием фруктозо-1,6-бисфосфата и далее участвуют в глюконеогенезе (реакции 8, 7, 5, 9). Фруктоза в печени включается главным образом во второй путь. Часть дигидроксиацетон-3-фосфата может восстанавливаться до глицерол-3-фосфата и участвовать в синтезе триацилглицеролов. Метаболизм галактозы Галактоза обр-ся в кишечнике в р-те гидролиза лактозы. Чтобы превратить галактозу в глюкозу, необ-мо изменить оптическую конфигурацию Н- и ОН-групп С4 атома в галактозе, т.е. провести реакцию эпимеризации. Эта реакция в клетке возможна только с УДФ-производным галактозы. УДФ-галактоза образуется из УДФ-глюкозы в ходе реакции, катализируемой уридилфосфат-4-эпимеразой

Включению галактозы в реакцию эпимеризации предшествует её фосфорилирование с образованием галактозо-1-фосфата (реакция 1).
Галактозо-1-фосфат замещает остаток глюкозы в УДФ-глюкозе с образованием УДФ-галактозы (реакция 2), т.е. прямая реакция фосфорилированной галактозы с УТФ не происходит.
(фермент галактозо-1 -фосфатуридилтрансферазой (ГАЛТ)).
Галактоза в составе нуклеотида включается в реакцию эпимеризации, в которой участвует эпимераза - NAD-зависимый фермент, катализирующий окисление и восстановление галактозы по С4углеродному атому (реакция 3).
Галактоза необходима для синтеза лактозы в грудных железах.
В период лактации галактоза не является незаменимым компонентом пищи, так как может образовываться из глюкозы.
40.Глюконеогенез.– процесс синтеза глюкозы de novo из неуглеродных предшественников. Главная функция – поддержание уровня глюкозы в крови во время голодания и интенсивной физической работы. Наиболее активно процесс протекает в печени, менее интенсивно в корковом слое почек и слизистом эпителии кишечника. Недостаток глюкозы в крови, прежде всего, ощущает головной мозг. Первичные субстраты глюконеогенеза - лактат, аминок-ты и глицерол. Включение этих субстратов в глюкон-нез зав-т от физио-го состояния орг-ма. Лактат - продукт анаэробного гликолиза. Он образуется при любых состояниях организма в эритроцитах и работающих мышцах. Таким образом, лактат используется в глюконеогенезе постоянно. Глицерол высвобождается при гидролизе жиров в жировой ткани в период голодания или при длительной физической нагрузке. Аминок-ты обр-ся в результате распада мышечных белков и включаются в глюконеогенез при длительном голодании или продолж-ой мышечной работе. Реакции глюконеогенеза Большинство реакций глюконеогенеза протекает за счёт обратимых реакций гликолиза и катализируется теми же ферментами. Однако 3 реакции гликолиза термодинамически необратимы. На этих стадиях реакции глюконеогенеза протекают другими путями. Образование фосфоенолпирувата, гидролиз фруктозо-1,6-бисфосфата и глюкозо-6-фосфата термодинамически необратимы и протекают другими путями. Образование фосфоенолпирувата из пирувата происходит в ходе двух реакций: пируват из цитозоля переносится в митохондрии и там карбоксилируется с образованием оксалоацетата. Митохондриальный фермент пируваткарбоксилаза, катализирующий данное превращение пирувата, в качестве кофермента содержит биотин. Реакция протекает с затратой молекулы АТР 
Для оксалоацетата внутренняя мембрана митохондрий непроницаема, транспорт оксалоацетата в цитоплазму клетки происходит с помощью малатного челночного механизма, смысл которого заключается в восстановлении оксалоацетата до малата под действием митохондриального фермента малатдегидрогеназы.
Малат выходит в цитоплазму, где цитоплазматическая малатдегидрогеназа окисляет малат до оксалоацетата. В последующей реакции, катализируемой ферментом фосфоенолпируват-карбоксикиназой, из оксалоацетата обр-ся фосфоенолпируват. Реакция Mg2+-зависимая и донором фосфата служит GTP. После образования фосфоенолпирувата процесс глюконеогенеза идет по обратимым реакциям гликолиза, вплоть до синтеза фруктозо-1,6-бисфосфата. Превращение фруктозо-1,6-бисфосфата во фруктозо-6-фосфат – необратимая реакция глюконеогенеза, а потому отщепление фосфатной группы катализируется фруктозо-1,6-фосфатазой. Образовавшийся фруктозо-6-фосфат фосфоглюкоизомеразой переводится в глюкозо-6-фосфат, который под действием глюкозо-6-фосфатазы (в процессе гликолиза этот фермент не участвует, и это еще одна необратимая реакция глюконеогенеза) теряет фосфатную группу и превр-ся в свободную глюкозу. После чего глюкоза транспортируется в кровь. В печени сущ-ют 4 фермента, которые принимают участие только в глюконеогенезе и катал-ют обходные реакции необратимых стадий гликолиза. Это - пируват-карбоксилаза, фосфоенолпируваткарбоксикиназа, фруктозо-1,6-бисфосфатаза и глюкозо-6-фосфатаза. Энергетический баланс глюконеогенеза из пирувата В ходе этого процесса расходуются 6 моль АТФ на синтез 1 моль глюкозы из 2 моль пирувата. Четыре моль АТФ расходуются на стадии синтеза фосфоенолпирувата из оксалоацетата и ещё 2 моль АТФ на стадиях образования 1,3-бисфосфоглицерата из 3-фосфоглицерата. Суммарный р-т глюконеогенеза из пирувата : 2 Пируват + 4АТР + 2GTP + 2NADH + 2H+ + 4Н2О → Глюкоза + 4ADP + 2GDP + 6Н3РО4 + 2NAD+ Регуляторным ферментом в глюконеогенезе является пируваткарбоксилаза, которая активируется ацетил-CоА тогда, когда в митохондриях накапливается больше данного субстрата, чем требуется для протекания цикла трикарбоновых кислот. Одновременно ацетил-СоА ингибирует пируватдегидрогеназный комплекс, что приводит к замедлению окисления пирувата и способствует вовлечению его в глюконеогенез.В регуляции глюконеогенеза играет фруктозо-1,6-бисфосфатаза, ингибируемая АМР. При высоком соотношении АТР/АМР активируется глюконеогенез и ингибируется гликолиз, т. к. АТР является ингибитором лимитирующего фермента гликолиза – фосфофруктокиназы. Установлено – наиболее мощным аллостеричеким регулятором является фруктозо-2,6-бисфосфат - ингибирует фруктозо-1,6-бисфосфатазу и активирует фосфофруктокиназу.
41. β-окисление жирных кислот. β-окисление циклический процесс, каждый цикл к-го заключается в удалении двууглеродного фрагмента в форме ацетил-СоА, начиная от карбокс-го конца жирной к-ты. Реакции окисления жирной кислоты происходят у β-углеродного атома. Реакции β-окисления и последующего окисления ацетил-КоА в ЦТК служат одним из основных источников энергии для синтеза АТФ по механизму окислительного фосфорилирования. β-Окисление жирных кислот происходит только в аэробных условиях, в матриксе митохондрий. Цикл включает четыре реакции: дегидрирование, гидратацию, дегидрирование и тиолитическое расщепление.
В первой реакции происходит дегидрирование ацил-СоА при участии FAD-зависимой ацил-СоА-дегидрогеназы, с образованием двойной связи между α- и β-атомами углерода в продукте реакции - еноил-КоА. .
Три вида ацил-СоА-дегидрогеназ осуществляют окисление длинно-, средне- и короткоцепочечных ацил-СоА эфиров жирных кислот.
Восстановленный в этой реакции кофермент FADH2 передаёт атомы водорода в ЦПЭ на кофермент Q. В результате синтезируются 2 молекулы АТФ.
Окисление с участием ацил-СоА-дегидрогеназ, аналогично дегидрированию, катализируемому сукцинатдегидрогеназой в цикле лимонной кислоты.
Продукт окисления еноил-СоА гидратируется под действием еноилгидратазы с образованием β-гидроксиацил-СоА.
Существуют еноил-СоА-гидратазы, проявляющие специфичность к цис- или транс-формам еноил-СоА-производных жирных кислот.
При этом транс-еноил-СоА гидратируется стереоспецифически в L-β-гидроксиацил-СоА, цис-изомеры в D-β-гидроксиацил-СоА.
В третьей реакции цикла β-окисления происходит дегидрирование L-β-гидроксиацил-СоА специфической только к L-изомерам β-гидроксиацил-СоА NAD+-зависимой дегидрогеназой.
Окислению подвергается β-углеродный атом молекулы.
Восстановленный NADH, окисляясь в ЦПЭ, обеспечивает энергией синтез 3 молекул АТФ.
Образующийся β-кетоацил-СоА в завершающей реакции цикла легко расщепляется тиолазой с образованием двух продуктов:
ацил-СоА, укороченного по сравнению с исходным на два углеродных атома, и
ацетил-СоА двууглеродной молекулы, отщепленной от жирнокислотной цепи. Ацил-СоА-произв-ое подвергается следующему циклу реакций β-окисления, а ацетил-СоА вступает в цикл лимонной к-ты для дальнейшего окис-ия. Продуктами каждого цикла β-окисления яв. FADH2, NADH и ацетил-КоА Энергетический баланс окисления на примере стеариновой кислоты Уравнение β-окисления стеароил-СоА:

Ацетил-СоА, образованный при окислении жирных кислот, далее подвергается окислению до СО2 и Н2О в цикле лимонной кислоты. Следующее уравнение результат окисления стеароил-СоА в ЦТК Окончательное уравнение полного окисления cтеароил-СоА до СО2 и Н2О (исходя из предположения, что GDP = ADP и GTP = ATP):


Наиболее активно β-окисление протекает в митохондриях печени, почек, скелетной и сердечной мышц.
β-окисление является источником эндогенной воды.
42.Биосинтез жирных кислот. Строение комплекса синтазы жирных кислот. Регуляция процесса. За исключением полиеновых эссенциальных жирных кислот (ЖК), все другие ЖК в организме животных и человека синтезируются. Синтез ЖК de novo называется липогенезом. Наиболее интенсивно липогенез происходит в печени. В качестве источника при синтезе ЖК используется ацетил-СоА. Углеводородные цепи ЖК собираются в ходе последовательного присоединения двууглеродных фрагментов. Липогенез не является процессом, обратным β-окислению. Он отличается от него по ряду параметров: биосинтез ЖК осуществляется в основном в цитозоле; источником двууглеродных фрагментов при наращивании цепи ЖК служит малонил-СоА, образующийся в результате присоединения СО2 к ацетил-СоА; на всех стадиях синтеза ЖК принимает участие ацил-переносщий белок − АПБ, а не HSCoA; для синтеза ЖК необходим NADPH, а в β-окислении в качестве кофермента используются FAD и NAD+;интермедиатами в ходе синтеза ЖК являются гидроксипроизводные, относящиеся к D-ряду, тогда как при окислении ЖК − гидроксипроизводные L-ряда. В цитозоле осуществляется синтез насыщенных жирных кислот с длиной углеводородной цепи до С16 (пальмитат). В митохондриях и ЭПР может происходить дальнейшее наращивание углеводородных цепей, кроме того, в ЭПР осуществляется превращение насыщенных ЖК в ненасыщенные. Строение синтазы жирных кислот Биосинтез ЖК осуществляется мультиферментным комплексом, который называется синтазой жирных кислот (пальмитатсинтаза, СЖК)
Мультиэнзимный комплекс синтазы ЖК у высокоорганизованных форм (млекопитающие, птицы, насекомые) характеризуется молекулярной массой 400-500 кДа, образован единственной полипептидной цепи, включающей около 2300 аминокислотных остатков. Этот комплекс состоит из двух идентичных субъединиц, т.е. является гомодимером. Каждая субъединица может катализировать семь различных реакций, из которых складывается синтез ЖК. Пространственное объединение нескольких реакций в мультиферментный комплекс (МФК) имеет ряд преимуществ по сравнению с отдельными ферментами: предотвращаются конкурентные реакции, последовательные реакции согласованы как на конвейере, реакции протекают эффективно, благодаря высокой концентрации субстрата и незначительным потерям его за счет диффузии. Каждая субъединица МФК включает 3 разл-х домена и 8 субдоменов: Домен I состоит из трех субдоменов: субдомен 1 − АПБ-S-ацетилтрансфераза, 60 кДа; субдомен 2 − АПБ-S-малонилтрансфераза, 23 кДа; субдомен 3 − β-кетоацил-АПБ-синтаза (конденсирующий фермент, 45 кДа). Домен I катализирует присоединение субстратов ацетил-СоА и малонил-СоА ацетилтрансферазой и малонилтрансферазой соответственно и последующую конденсацию обоих партнеров β-кетоацил-синтазой. Домен II также состоит из трех субдоменов: субдомен 4 − β-кетоацил-АПБ-редуктаза, 21 кДа; субдомен 5 − β-гидроксиацил-АПБ-дегидратаза, 50 кДа; субдомен 6 − еноил-АПБ-редуктаза, 14 кДа. К субдомену 4 присоединен ацилпереносящий белок (АПБ), 15 кДа. Домен II восстан-ет растущую цепь ЖК с помощью вышеназванных трех ферментов. Домен III содержит субдомен 7 − ацил-АПБ-гидролаза, тиоэстераза, 33 кДа. Домен III после семь циклов удлинения цепи катализирует высвобождение готового продукта − пальмитата с помощью гидролитического фермента тиоэстеразы. Центральную роль в функционировании комплекса СЖК играет ацилпереносящий белок, простетической группой которого является 4-фосфопантетеин. Функция АПБ в биосинтезе ЖК аналогична функции СоА в β-окислении жирных кислот. В процессе наращивания цепи ЖК промежуточные продукты связаны с АПБ.
Простетическая группа АПБ служит «вращающейся ручкой», которая перемещает промежуточные соединения от активного центра одного фермента к другому.
Растущая цепь ЖК всегда связана с фосфопантетеиновой группой ацилпереносящего белка.
Механизм синтеза жирных кислот Для того чтобы синтезировать жирную кислоту, нужно последовательно присоединять к ацетил-СоА двууглеродные единицы. Активным донором таких единиц является малонил-СоА, хотя его малонильный остаток содержит не два, а три углеродных атома. Малонил-СоА образуется из ацетил-СоА в результате присоединения карбоксильной группы. Но прежде чем это произойдет, находящийся в матриксе митохондрий ацетил-СоА должен попасть в цитоплазму, где локализован комплекс синтазы жирных кислот.
|
из
5.00
|
Обсуждение в статье: Энергетический эффект цикла Кребса |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

