 |
Главная |
Транспорт АТР из митохондрий в цитоплазму клетки.
|
из
5.00
|
Синтезируется АТФ в матриксе митохондрий при окислительном фосфорилировании. После синтеза АТФ переносится в цитоплазму путем облегчённой диффузии по градиенту концентраций, поскольку основные процессы, в которых АТФ потребляется, протекают в цитоплазме. Для этого используется специфический для АТФ транспортный белок — АТФ/АДФ-транслоказа. Это интегральный белок, локализован во внутренней мембране митохондрий.
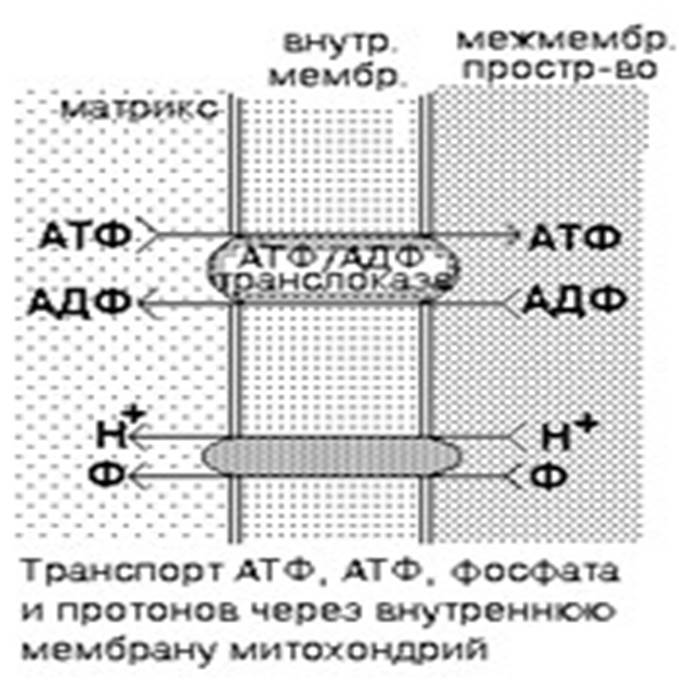
Во внутренней мембране митохондрий есть белок-переносчик — АТФ/АТФ-транслоказа, который имеет 2 центра связывания: со стороны матрикса для АТФ, снаружи — для АДФ. При изменении конформации АТФ/АДФ-транслоказы АДФ переносится в матрикс (обменная диффузия), а АТФ — в межмембранное пространство, а затем — в цитоплазму, где используется. Транслоказа, которая катализирует перенос 1 молекулы АТР из матрикса в цитоплазму с одновременным переносом 1 молекулы ADP в обратном направлении. Система переноса ATP/ADP является весьма специфичной. Она обладает высоким сродством как к АТР, так и к ADP, но не проявляет сродства к другим нуклеотидам (ХТР, XDP). Для образования АТФ в матрикс всё время должен поступать неорганический фосфат (Ф). Для этого во внутренней мембране митохондрий есть транспортная система, которая обеспечивает перенос фосфата в матрикс сопряженно с переносом Н+. Это белок-переносчик, который имеет 2 центра связывания: для Ф и Н+. Ф и Н+ вместе переносятся из межмембранного пространства в матрикс. Известны некоторые вещества, которые способны разобщать процессы окисления и фосфорилирования, приводя тем самым к уменьшению коэффициента р/о. К ним относятся йодсодержащие гормоны щитовидной железы (тироксин, трийодтиронин), а также некоторые ксенобиотики (например, 2,4-динитрофенол). Такие вещества известны под общим названием «РАЗОБЩАЮЩИЕ ЯДЫ». Они могут образовывать собственные протонные каналы во внутренней мембране митохондрий. Поэтому часть протонов, вместо того, чтобы идти обратно в матрикс по протонному каналу АТФ-синтетазы, уходит туда по каналам веществ-разобщителей. В результате АТФ образуется меньше, и часть энергии выделяется в виде тепла.
Она может быть ингибирована весьма малыми концентрациями атрактилозидатоксического растительного гликозида.
49.Токсичность кислорода. Антиоксидантная защитная система, ферментативные и неферментативные компоненты. Кислород, необходимый организму для функционирования ЦПЭ и многих других реакций, является одновременно и токсическим веществом, если из него образуются так называемые активные формы.
К активным формам кислорода относят: ОН• - гидроксильный радикал;
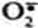 - супероксидный анион; Н2О2- пероксид водорода.
- супероксидный анион; Н2О2- пероксид водорода.
Активные формы кислорода образуются во многих клетках в результате последовательного одноэлектронного присоединения 4 электронов к 1 молекуле кислорода. Конечный продукт этих реакций - вода, но по ходу реакций образуются химически активные формы кислорода. Наиболее активен гидроксильный радикал, взаимодействующий с большинством органических молекул. Он отнимает от них электрон и инициирует таким образом цепные реакции окисления.
Утечка электронов из ЦПЭ и непосредственное их взаимодействие с кислородом - основной путь образования активных форм кислорода в большинстве клеток. Наличие в клетках Fe2+ или ионов других переходных металлов увеличивает скорость образования гидроксильных радикалов и других активных форм кислорода: Fe 2+ + Н2О2 → Fe 3+ + ОН- + ОН•.
Напр, в эритроцитах окисление иона железа гемоглобина способствует образованию супероксидного аниона. Активные формы кислорода повреждают структуру ДНК, белков и различные мембранные структуры клеток. В результате появления в гидрофобном слое мембран гидрофильных зон за счёт образования гидропероксидов жирных кислот в клетки могут проникать вода, ионы натрия, кальция, что приводит к набуханию клеток, органелл и их разрушению.
Фер-ты антиоксидантного действия:К ферм-там, защищающим клетки от дей-ия активных форм кислорода, относят супероксиддисмутазу, каталазу и глутати-онпероксидазу; Наиболее активны эти ферм-ты в печени, надпочечниках и почках, где соде-ие митохондрий, цитохрома Р450 и пероксисом особенно велико.
1. Супероксиддисмутаза (СОД) превращает супероксидные анионы в пероксид водорода: 2 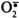 + 2 H + → H 2 O 2 + O 2
+ 2 H + → H 2 O 2 + O 2
Изоферменты СОД находятся и в цитозоле и в митохондриях и являются как бы первой линией защиты, потому что супероксидный анион образуется обычно первым из активных форм кислорода при утечке электронов из дыхательной цепи. СОД - индуцируемый фермент, т.е. синтез его увеличивается, если в клетках активируется перекисное окисление.
2. Каталаза разрушает пероксид водорода, который может инициировать образование самой активной формы ОН•. 2Н2О2 → 2 Н2О + О2.
Каталаза находится в основном в пероксисомах, где образуется наибольшее количество пероксида водорода, а также в лейкоцитах, где она защищает клетки от последствий "респираторного взрыва"(состояние фагоцитирующих клеток (нейтрофилов, эозинофилов, макрофагов), наступающее вскоре после захвата ими чужеродного материала, ассоциируется с активацией и интенсификацией процесса образования активных форм кислорода).
3. Глутатионпероксидаза - важнейший фермент, обеспечивающий инактивацию активных форм кислорода, так как он разрушает и пероксид водорода и гидропероксиды липидов. Он катализирует восстановление пероксидов с помощью трипептида глутатиона (γ -глутамилцистеинилглицин). Сульфгидрильная группа глутатиона (GSH) служит донором электронов и, окисляясь, образует дисульфидную форму глутатиона, в которой 2 молекулы глутатиона связаны через дисульфидную группу. Н2О2 + 2 GSH → 2 Н2О + G - S - S - G .
Окисленный глутатион восстанавливается глутатионредуктазой:
GS - SG + NADPH + Н+ → 2 GSH + NADP +.
Глутатионпероксидаза, которая восстанавливает гидропероксиды липидов в составе мембран, в качестве кофермента исп-ет селен (необходимый микроэлемент пищи). При его недостатке активность антиоксидантной защиты снижается.
Витамины, обладающие антиоксидантным действием( неферментативные компоненты антиоксидантной защитной системы)
Витамин Е ( α -токоферол) - наиболее распространённый антиоксидант в природе - яв. липофильной молекулой, способной инактивировать свободные радикалы непосредственно в гидрофобном слое мембран и таким образом предотвращать развитие цепи перекисного окисления. Различают 8 типов токоферолов, но α-токоферол наиболее активен. Витамин Е отдаёт атом водорода свободному радикалу пероксида липида ( ROO •), восстанавливая его до гидропероксида ( ROOH ) и т. о. останавливает развитие ПОЛ(перекисное окисление липидов). Свободный радикал вит. Е, образовавшийся в р-те реакции, стабилен и не способен участвовать в развитии цепи. Наоборот, радикал витамина Е непосредственно взаимодействует с радикалами липидных перекисей, восстанавливая их, а сам превращается в стабильную окисленную форму - токоферолхинон.
Витамин С (аскорбиновая кислота) также является антиоксидантом и участвует с помощью двух раз-х механизмов в ингибировании ПОЛ (перекисное окисление липидов). Во-первых, витамин С восстанавливает окисленную форму витамина Е и таким образом поддерживает необходимую концентрацию этого антиоксиданта непосредственно в мембранах клеток. Во-вторых, витамин С, будучи водорастворимым витамином и сильным восстановителем, взаимодействует с водораство-ыми активными формами кислорода - , Н2О2, ОН• и инактивирует их.
β -Каротин, предшественник витамина А, также обладает антиоксидантным действием и ингибирует ПОЛ. Показано, что растительная диета, обогащённая витаминами Е, С, каротиноидами, существенно уменьшает риск развития атеросклероза и заболеваний ССС, подавляет развитие катаракты - помутнения хрусталика глаза, обладает антиканцерогенным действием. Имеется много доказательств в пользу того, что положительное действие этих компонентов пищи связано с ингибированием ПОЛ и других молекул и, следовательно, с поддержанием нормальной структуры компонентов клеток.
50.Метаболизм кетоновых тел. К кетоновым телам относят три соединения близкой структуры – ацетоацетат, 3-гидроксибутират и ацетон.
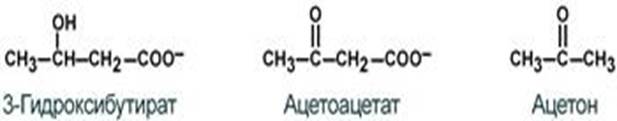
Стимулом для образования кетоновых тел служит поступление большого количества жирных кислот в печень. При состояниях, активирующих липолиз в жировой ткани,(голодание, сахарный диабет 1 типа, длительные физ-ие нагрузки) не менее 30% образованных жирных кислот задерживаются печенью. Так как синтез ТАГ в этих условиях невозможен, то жирные кислоты из цитозоля попадают в митохондрии и окисляются с обр-ем кетоновых тел. В обычных условиях синтез кетоновых тел также идет, хотя в гораздо меньшем кол-ве.
Синтез ацетоацетата происходит только в митохондриях печени, далее он либо восстанавливается до 3-гидроксибутирата, либо спонтанно декарбоксилируется до ацетона. Далее все три соединения поступают в кровь и разносятся по тканям. Ацетон, как летучее вещество, легко удаляется с выдыхаемым воздухом и потом. Если ацетоуксусная и бета--гидроксимасляная кислоты окисляются в митохондриях для получения энергии, то ацетон — метаболический «тупик»(не является носителем энергии). Все кетоновые тела могут выделяться с мочой. Используются кетоновые тела клетками всех тканей, кроме печени и эритроцитов. Ацетоуксусная и 3-гидроксибутират поступают из печени в периферические ткани, включая мышечную, сердечную и нервную, где конвертируются в ацетил-КоА с последующим образованием АТФ. Особенно активно, даже в норме, они потребляются миокардом и корковым слоем надпочечников. В тканях реакции утилизации кетоновых тел в целом совпадают с обратным направлением реакций синтеза. В цитозоле клеток 3-гидроксибутират окисляется, образующийся ацетоацетат проникает в митохондрии, активируется за счет сукцинил-SКоА и превращается в ацетил-SКоА, который сгорает в ЦТК (в переферических тканях, например). Нервная ткань получает все количество требуемой энергии за счет окисления глюкозы, она не способна использовать жирные кислоты для синтеза АТФ. В случае голодания мозга его функции могут быть обеспечены в течение нескольких недель за счет синтеза кетоновых тел в печени. При этом кетоновые тела поступают в мозг, где последовательность реакций:
3-гидроксибутират 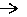 ацетоуксусная кислота
ацетоуксусная кислота 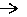 2 ацетил-КоА
2 ацетил-КоА 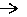 цикл трикарбоновых кислот
цикл трикарбоновых кислот
переключает ткань мозга на кетоновые тела в качестве источника энергии. Это нормальный ответ организма на недостаток углеводов в организме. Следовательно, кетоновые тела являются обычными компонентами крови и важным энергетическим источником для сердечной и скелетных мышц и для почек. В результате окисление молекулы р-гидроксимасляной кислоты до С02 и Н20 сопровождается синтезом 27 молекул АТФ.
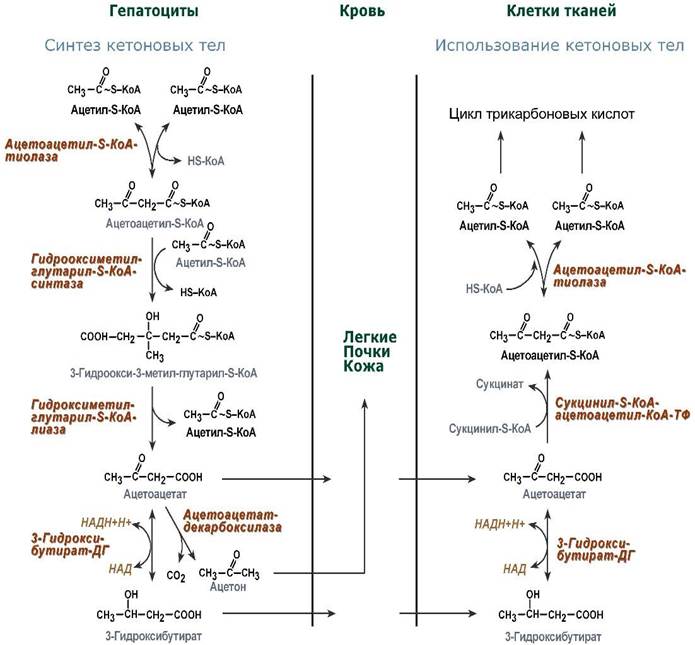
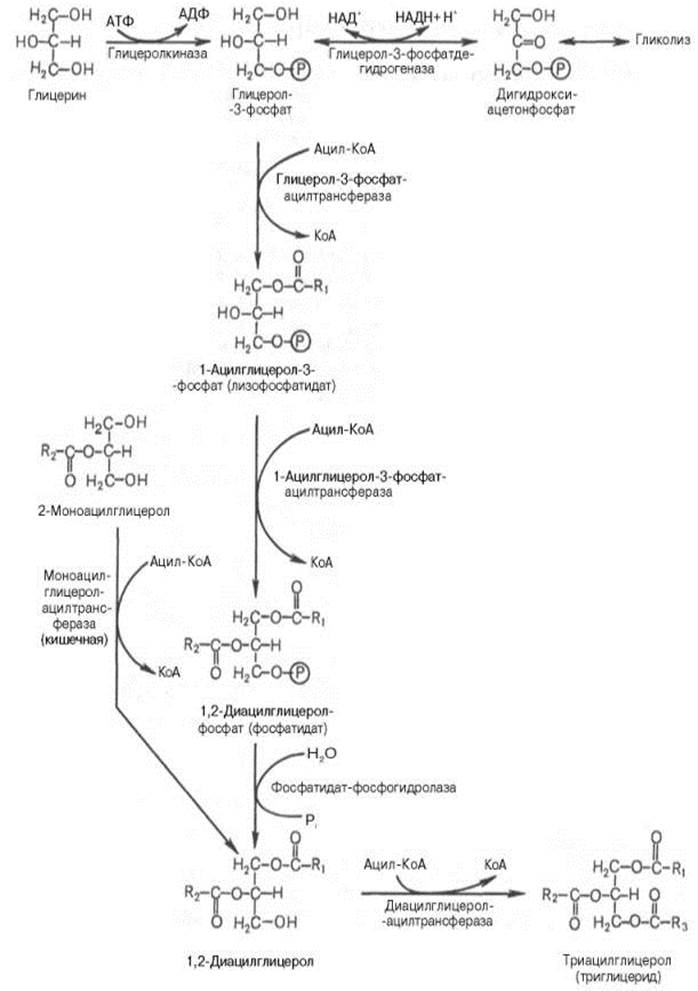
51.Два пути биосинтеза триацилглицеролов. Синтез триглицеридов происходит из глицерина и жирных кислот (главным образом стеариновой, пальмитиновой и олеиновой). Установлено, что боль-во ферментов, участвующих в биосинтезе триглицеридов, находятся в эндоплазматическом ретикулуме, и только некоторые, например глицерол-3-фосфат-ацилтрансфераза,– в митохондриях. Путь биосинтеза триглицеридов в тканях протекает через образ-ие глицерол-3-фосфата как промежуточного соед-ия.
Синтез триглицеридов (триацилглицеролов) в тканях происходит с учетом двух путей образования глицерол-3-фосфата и возможности синтеза триглицеридов в стенке тонкой кишки из β-моноглицеридов, поступающих из полости кишечника в больших количествах после расщепления пищевых жиров.
1 этап: образование глицерол-3-фосфата (2 пути его образования):
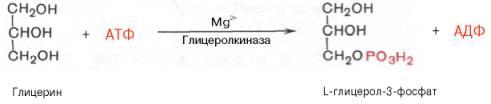
1. Фосфорилирование глицерина за счет АТФ в реакции, катализируемой глицеролкиназой:В почках, а также в стенке кишечника, где активность фермента глицеролкиназы высока, глицерин фосфорилируется за счет АТФ с обр-ем глицерол-3-фосфата:
2. Восстановление промежуточного продукта гликолиза – диоксиацетонфосфата под действием цитоплазматического НАД-зависимого фермента глицеролфосфатдегидрогеназы:В жировой ткани и мышцах вследствие очень низкой активности глицеролкиназы образование глицерол-3-фосфата в основном связано с процессами гликолиза и гликогенолиза. Известно, что в процессе гликолитического распада глюкозы образуется дигидроксиацетонфосфат. Последний в присутствии цитоплазматической глицерол-3-фосфатдегидрогеназы способен превращаться в глицерол-3-фосфат:

Отмечено, что если содержание глюкозы в жировой ткани понижено (нап., при голодании), то образуется лишь незначительное количество глицерол-3-фосфата и освободившиеся в ходе липолиза свободные жирные кислоты не могут быть использованы для ресинтеза триглицеридов, поэтому жирные кислоты покидают жировую ткань. Напротив, активация гликолиза в жировой ткани способствует накоплению в ней триглицеридов, а также входящих в их состав жирных кислот. В печени наблюдаются оба пути образования глицерол-3-фосфата.
2 этап: последовательное ацилирование глицерол-3-фосфата:
Образовавшийся тем или иным путем глицерол-3-фосфат последовательно ацилируется двумя молекулами КоА-производного жирной кислоты (т.е. «активными» формами жирной кислоты – ацил-КоА). В результате образуется фосфатидная кислота (фосфатидат):
Примечание: (ацилирование глицерол-3-фосфата протекает последовательно, т.е. в 2 этапа. Сначала глицерол-3-фосфат-ацилтрансфераза катализирует образование лизофосфатидата (1-ацилглицерол-3-фосфата, а затем 1-ацилглицерол-3-фосфат-ацилтрансфераза катализ-ет обр-ие фосфатидата (1,2-диацилглицерол-3-фосфата).
3 этап: гидролиз фосфатидной кислоты до 1,2-диацилглицерола:
Фосфатидная кислота гидролизуется фосфатидатфосфогидролазой до 1,2-диглицерида (1,2-диацилглицерола):
4 этап: ацилирование 1,2-диацилглицерола (последняя реакция, образование триацилглицерола):1,2-диглицерид ацилируется третьей молекулой ацил-КоА и превращается в триглицерид (триацилглицерол). Эта реакция катализируется диацилглицеролацилтрансферазой:

Общая схема:
52.Биосинтез холестерина. Роль гидроксиметилглутарилСоА редуктазы в регуляции этого процесса. Холестерин — важная составная часть клеточных мембран животных клеток. Примерно половина суточной нормы холестерина синтезируется в кишечнике, коже и главным образом в печени (примерно 50%), а остальной холестерин поступает с пищей.
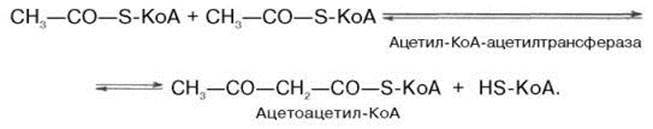
Биосинтез холестерина можно разделить на четыре этапа. На первом этапе из трех молекул ацетил-КоА образуется мевалонат (1). На втором этапе мевалонат превращается в «активный изопрен», изопентенилдифосфат (2). На третьем этапе шесть молекул изопрена полимеризуются с образованием сквалена (3). Наконец, сквален циклизуется с отщеплением трех атомов углерода и превращается в холестерин (4) . (1)Обр-ие мевалоната: Рассмотрим стадию превращения активного ацетата в мевалоновую к-ту. Начальным этапом синтеза мевалоновой кислоты из ацетил-КоА яв. Обр-ие ацетоацетил-КоА посредством обратимой тиолазной реакции:
Затем при последующей конденсации ацетоацетил-КоА с 3-й молекулой ацетил-КоА при участии гидроксиметилглутарил-КоА-синтазы (ГМГ-КоА-синтаза) образуется β-гидрокси-β-метилглутарил-КоА:
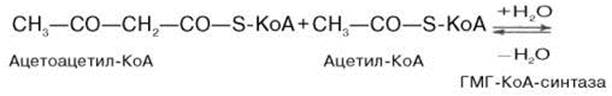
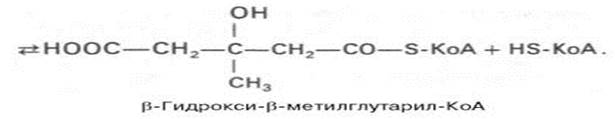
Далее β-гидрокси-β-метилглутарил-КоА под действием регуляторного фермента НАДФ-зависимой гидроксиметилглутарил-КоА-редуктазы (ГМГ-КоА-редуктаза) в р-те восстан-ия одной из карбокс-х групп и отщепления HS-KoA превр-ется в мевалон-ю к-ту:
ГМГ-КоА-редуктазная реакция – первая практически необратимая реакция в цепи биосинтеза холестерина. Она протекает со значительной потерей свободной энергии (около 33,6 кДж).. Процесс восстановления требует затраты двух молекул NADPH. Источником NADPH является пентозофосфатный путь окисления глюкозы, а также NADP+-зависимые цитозольные малатдегидрогеназная и изоцитратдегидрогеназная реакции. Данная реакция лимитирует скорость биосинтеза холестерина
(2) Реакции II стадии начинаются с фосфорилирования мевалоновой кислоты с помощью АТФ. Мевалонат дважды подвергается фосфорилированию по 5-ОН-группе при участии киназ. Донором фосфатных групп в этих реакциях служит АТР. Пирофосфомевалонат подвергается декарбоксилированию и дегидратированию, превращаясь в изопентенилпирофосфат (ИПФ, С5). Изопентенилпирофосфат активная изопреноидная единица, широко распространенная в природе и участвующая не только в синтезе ХС, но в синтезе каротиноидов, боковых цепей убихинонов, витаминов К и Е.
ИПФ изомеризуется в диметилаллилпирофосфат (ДПФ, С5). Взаим-ие ИПФ с молекулой диметилаллилпирофосфата, катализируемое изопентенилтрансферазой, приводит к образованию геранилпирофосфата (С10).Изопентенилтрансфераза осуществляет перенос диметилаллильного радикала на раскрывающуюся двойную связь в молекуле ИПФ. При этом происходит миграция двойной связи и потеря одной молекулы пирофосфата.
Затем оба изомерных изопентенилпирофосфата (диметилаллилпирофосфат и изопентенилпирофосфат) конденсируются с высвобождением пирофосфата и образованием геранилпирофосфата .
К геранилпирофосфату вновь присоединяется изопентенилпирофосфат. В результате этой реакции образуется фарнезилпирофосфат(С15) .Освобождающийся в этой и в предыдущей реакции пирофосфат гидролизуется неорганической пирофосфатазой, что обеспечивает необратимость биосинтетического процесса.
(3) Образование сквалена из фарнезилпирофосфата и превращение сквалена в ланостерол. В результате НАДФН-зависимой восстановительной конденсации 2 молекул фарнезилпирофосфата образуется сквален. Две молекулы фарнезилпирофосфата, соединяясь «голова к голове» и теряя каждая свой пирофосфат, образуют сквален, содержащий 30 атомов углерода. Сквален образуется из прескваленпирофосфата под действием фермента скваленсинтазы, локализованной в эндоплазматическом ретикулуме.Источником атомов водорода в этой реакции является NADPH.Сквален непредельный углеводород, состоящий их шести изопреноидных единиц (С30). Молекула сквалена легко принимает пространственную конфигурацию, близкую к пространственной конфигурации стеролов.На стадии образования сквалена завершается анаэробная фаза биосинтеза ХС.
На первом этапе при участии сквален-эпоксидазы, являющейся монооксигеназой, сквален легко окисляется с образованием сквален-2,3-эпоксида. Ланостерол-синтаза осуществляет замыкание шести и пятичленных циклов в результате протонирования эпоксидной группы и смещения электронной плотности в системе двойных связей сквалена. По такому пути протекает образование ланостерола в клетках печени. У растений и других организмов в циклизации сквален-2,3-эпоксида принимают участие другие циклизующие ферментные системы с образованием других продуктов, а не ланостерола. Ланостерол имеет гидроксильную группу в положении 3 и три лишние по сравнению с ХС метильные группы. Они окисляются до карбоксильных, которые затем удаляются декарбоксилированием.
(4) Превращение ланостерола в холестерол
Процесс превращения ланостерина в холестерин включает ряд реакций, сопровождающихся удалением трех метильных групп, насыщением двойной связи в боковой цепи и перемещением двойной связи в кольце В из положения 8, 9 в положение 5, 6). Преобразование ланостерола многоступенчатый процесс, в ходе которого образуются разнообразные индивидуальные стеролы (зимостерол, десмостерол), характерные для животного и растительного мира.
Хотя ланостерол и похож по структуре на холестерол, для его превращения в ХС требуется 20 дополнительных реакций. Ферменты, ответственные за эту трансформацию, локализованы в ЭПР. Преобразование ланостерола в ХС может идти двумя путями. Один из них восстановление десмостерола. Другой путь включает образование 7-дегидролхолестерола как предпоследнего интермедиата при синтезе холестерина.
Роль гидроксиметилглутарилСоА редуктазы в регуляции этого процесса: Реакцией, регулирующей скорость биосинтеза холестерина в целом, является восстановление β-гидрокси-β-метилглутарил-КоА в мевалоновую кислоту, катализируемое ГМГ-КоА-редуктазой.
Фосфорилированная редуктаза представляет собой неактивную форму фермента.Данный фермент испытывает регуляторное воздействие ряда факторов (инсулин и тироксин стимулируют фермент, глюкагон тормозит; холестерин, поступающий с пищей,..). В частности, скорость синтеза редуктазы в печени подвержена четким суточным колебаниям: максимум ее приходится на полночь, а минимум – на утренние часы. Активность ГМГ-редуктазы возрастает при введении инсулина и тиреоидных гормонов. Это приводит к усилению синтеза холестерина и повышению его уровня в крови. При голодании, тиреоидэктомии, введение глюкагона и глюкокортикоидов, напротив, отмечается угнетение синтеза холестерина, что прежде всего связано со снижением акт-ти ГМГ-КоА-редуктазы.
|
из
5.00
|
Обсуждение в статье: Транспорт АТР из митохондрий в цитоплазму клетки. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

