 |
Главная |
Амилолитические ферменты: характеристика.
|
из
5.00
|
В двенадцатиперстной кишке рН среды желудочноro содержимого нейтрализуется, т. к. секрет поджелудочной железы имеет рН – 7,5-8,0 и содержит бикарбонаты (НСО3¯).
С секретом поджелудочной железы в кишечник поступает панкреатическая α-амилаза. Этот фермент гидролизует α-l,4-гликозидные связи в крахмале и декстринах.
Продукт переваривания крахмала на этом этапе – дисахарид мальтоза, содержащая 2 остатка глюкозы, связанных α-l,4-связью.
Из тех остатков глюкозы, которые находятся в местах разветвления и соединены α-l,6-гликозидной связью, образуется дисахарид изомальтоза.
Кроме того, образуются олигосахариды, содержащие 3-8 остатков глюкозы, связанных α-1,4 и α-l,6-связями
α-Амилаза поджелудочной железы (так же, как и α-амилаза слюны) действует как эндогликозидаза.
Панкреатическая α-амилаза не расщепляет α-l,6-гликозидные связи в крахмале. Этот фермент также не гидролизует β-1,4-гликозидные связи, которыми соединены остатки глюкозы в молекуле целлюлозы.
Целлюлоза, таким образом, проходит через кишечник неизменённой.
В толстом кишечнике целлюлоза может подвергаться действию бактериальных ферментов и частично расщепляться с образованием спиртов, органических кислот и СО2.
Продукты бактериального расщепления целлюлозы важны, как стимуляторы перистальтики кишечника.
Мальтоза, изомальтоза и трисахариды, образующиеся в верхних отделах кишечника из крахмала, – промежуточные продукты. Дальнейшее их переваривание происходит в тонком кишечнике под действием специфических ферментов.
Сахароза и лактоза также гидролизуются специфическими дисахаридазами.
Особенность переваривания углеводов в тонком кишечнике заключается в том, что активность специфических олиго- и дисахаридаз в просвете кишечника низкая. Но ферменты активно действуют на поверхности эпителиальных клеток кишечника.
Ферменты, расщепляющие гликозидные связи в дисахаридах дисахаридазы, образуют ферментативные комплексы, локализованные на наружной поверхности цитоплазматической мембраны энтероцитов.
Сахаразо-изомальтазный комплекс
Ферментативный комплекс состоит из двух полипептидных цепей и имеет доменное строение. Сахаразо-изомальтазный комплекс прикрепляется к мембране микроворсинок кишечника с помощью гидрофобного (трансмембранного) домена, образованного N-концевой частью полипептида.
Каталитический центр выступает в просвет кишечника. Связь этого пищеварительного фермента с мембраной способствует эффективному поглощению продуктов гидролиза клеткой.
В тощей кишке содержание сахаразо-изомальтазного ферментативного комплекса достаточно высокое, но оно снижается в проксимальной и дистальной частях кишечника.
32.Гликолиз. Регуляция гликолиза. Гликолиз — фермент-ое расщепление глюкозы, протекающее с обр-ем двух молекул молочной к-ты в анаэробных условиях с одновре-ым обр-ем АТФ.
Схема распада глюкозы до молочной к-ты:Глюкозо ---> 2Пируват->2 м-я к-та Гликолиз протекает в тканях человека и животных.
Молочная кислота конечный продукт анаэробного (-О2) распада глюкозы.
В случае аэробных условий схема распада глюкозы усложняется:

Гликолиз протекает в гиалоплазме (цитозоле) клетки. И проникает в клетку с помощью специального переносчика или системы активного транспорта.
Установлено, что гликолитические ферменты способны связываться с мышечными белками.
На долю F-актина приходится больше связанных ферментов гликолиза, чем на долю миозина, актомиозина или белков стромы.
Из ферментов наибольшим сродством к F-актину обладает альдолаза и несколько меньшим – глицеральдегид-3-фосфатдегидрогеназа (ГАФДГ).
Среди других ферментов, проявляющих определенную склонность к связыванию, необходимо отметить фосфофруктокиназу (ФФК), 3-фосфоглицераткиназу, пируваткиназу (ПК) и лактатдегидрогеназу (ЛДГ).
При аэробных условиях пируват проникает в митохондрии, где полностью окисляется до СО2 и Н2О. Если содержание кислорода недостаточно, как, например, в активно сокращающейся мышце, пируват превращается в лактат.
Т. о., гликолиз – это не только главный путь утилизации глюкозы в клетках, но и уникальный путь, поскольку он может использовать кислород, если последний доступен (аэробные условия), но может протекать и в его отсутствие (анаэробные условия). Кроме того, на промежуточных стадиях образуются трехуглеродные фрагменты, которые испо-ся для биосинтеза ряда в-в.
В анаэробных условиях гликолиз – единственный процесс в животном организме, поставляющий энергию.
Именно благодаря ему организм человека и животных опре-ый период может осуществлять ряд физио-х функций в условиях недостаточности кислорода.
I/Первой реакцией гликолиза является фосфорилирование.
Перенос фосфорильной группы с АТФ к гидроксильной группе при С-6 глюкозы, катализируется реакция гексоки- назой. Реакция практически необратима.
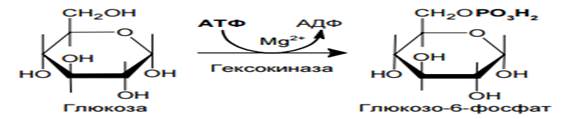
Наиболее важным свойством гексокиназы является ее ингибирование глюкозо-6-фосфатом, который служит одновременно и продуктом реакции, и аллостерическим ингибитором.
Гексокиназа имеет высокое сродство (низкую Кm) к своему субстрату – глюкозе; ее функция состоит в том, чтобы обеспечить захват тканью глюкозы даже при низких концентрациях последней в крови. Фосфорилируя практически всю поступающую в клетку глюкозу, гексокиназа поддерживает значительный градиент концентрации глюкозы между кровью и внутриклеточной средой.
Фермент действует как на α-, так и на β-аномеры глюкозы; он фосфорилирует также и другие гексозы (в частности, D-фруктозы, D-маннозы и т.д.), но со значительно меньшей скоростью.
В печени кроме гексокиназы существует фермент глюкокиназа, который катализирует фосфорилирование только D-глюкозы. В мышечной ткани этот фермент отсутствует. Функция глюкокиназы состоит в «захватывании» глюкозы из кровотока после приема пищи (когда концентрация глюкозы в крови повышается).
В отличие от гексокиназы она имеет высокое значение Кm для глюкозы и эффективно функционирует при концентрации глюкозы в крови выше 100 мг/100 мл.
Глюкокиназа специфична только к глюкозе.
Глюкозо-6-фосфат занимает важное положение в области стыковки ряда метаболических путей (гликолиз, глюконеогенез, пентозофосфатный путь, гликогенез и гликогенолиз).
|
из
5.00
|
Обсуждение в статье: Амилолитические ферменты: характеристика. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

