 |
Главная |
Относительная сила кислот и оснований (схема Косселя) на примерах
|
из
5.00
|
Свойства волновой функции. Понятие об уравнении Шредингера. Что такое узловые поверхности?
Вопрос 1 +
Узловой поверхностей орбитали наз. геометрическое место точек, где волновая функ.  (
(  ). Узловые поверхности могут быть сферическими, плоскими и коническими. По определению каждая орбиталь имеет сферическую узловую поверхность с бесконечным радиусом. Главное кв. число равно общему числу узловых поверхностей данной орбитали.
). Узловые поверхности могут быть сферическими, плоскими и коническими. По определению каждая орбиталь имеет сферическую узловую поверхность с бесконечным радиусом. Главное кв. число равно общему числу узловых поверхностей данной орбитали.
3. Дайте определения: электронный слой, электронная оболочка, электронное облако, электронная орбиталь, узловая поверхность. Сколько максимум электронов может быть в …слое, на…оболочке
Узловая поверхность – геометрическое место точек, в которых невозможно обнаружить 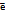 (Ψ=0, Ψ2=0)
(Ψ=0, Ψ2=0)
Электронный слой – совокупность электронов, характеризующихся одним и тем же значением главного квантового числа (n)
Электронная оболочка – совокупность электронов с одним и тем же значением побочного квантового числа (l): s, p, d, f – оболочки.
Электронная орбиталь – это совокупность электронов с одним и тем же значением магнитного квантового числа (ml) (всего их – (2l+1)).
Электронное облако – часть простарнства, вокруг ядра, где есть вероятность нахождения электрона и его различного положения.
Max емкость слоя: 2n2 (k=2, L=8, M=18 и т.д.)
Max емкость оболочки: 2(2l+1) (s=2, p=6, d=10, f=14)
число зн спина число орбиталей
Принцип Паули и правило Хунда. Сколько максимум электронов может быть в электронном слое, электронной оболочке, на орбитали? Какую форму имеют s p d – орбитали?
Принцип Паули: в атоме не может быть двух электронов с одинаковым набором 4-х квантовых чисел.
Правило Хунда: суммарный спин электронов оболочки должен быть макссиммальным.
Максимальное число е в оболочке l: 2(2l+1).
Максимальное число е в слое n: 2n2.
Максимальное число на орбитали: 2е.
Формы s-, p-, d- орбиталей:
Энергия электрона в многоэлектронном атоме. Энергетический ряд атомных орбиталей.
Энергия электрона в атоме водорода (теория Бора) определяется единственным (главным) квантовым числом, а в многоэлектронном атоме – главным и орбитальным квантовыми числами. В целом энергия электрона возрастает по мере роста суммы названных квантовых чисел при доминирующем значении квантового числа. При одинаковой сумме энергия состояния с меньшим значением гл. кв. числа ниже. В соответствии с этими правилами энергетический ряд атомных орбиталей выглядит следующим образом:
1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f<5d<6p<7s<5f<6d<7p и т.д.
Относительная сила кислот и оснований (схема Косселя) на примерах
Сила кислородных кислот будет возрастать с увеличением степени окисления атома элемента и уменьшается радиуса его иона. У оснований наоборот.
Сила бескислородных кислот возрастает с уменьшением степени окисления атома элемента и увеличением радиуса его иона. Сила бескислородных кислот в растворе будет возрастать в подгруппе, т.к при одинаковой степени окисления атома элемента увеличивается радиус его иона.
Более сильным электролитам из двух считается тот, у которого при одинаковой молярной концентрации больше степень диссоциации
6. Современная формулировка периодического закона. Энергия ионизации и сродство к электрону, закономерности в их изменении по периодам и группам периодической системы
Свойства химических элементов, а также формы и свойства образуемых ими соединений, находятся в периодической зависимости от величины заряда ядер их атомов.
Энергия ионизации - представляет собой наименьшую энергию, необходимую для удаления электрона от свободного атома в его низшем энергетическом (основном) состоянии на бесконечность.
В целом в периоде в соответствии с тенденцией изменения атомных радиусов и увеличением притяжения электронов к ядру должна возрастать. Однако этот рост неравномерен.
Энергия, выделяющаяся при добавлении электрона к нейтральному атому, переходящему при этом в отрицательный однозарядный ион, наз. сродством к электрону. Сродство к двум или более электронам отрицательно. Наиболее часто энергию ионизации и сродство к электрону выражают в электроновольтах (эВ). 1 эВ = 1,60.10-19 Дж = 1,6.10-12 эрг.
Факторы, определяющие энергию ионизации (энтальпию ионизации):
1) эффект экранирования заряда ядра глубинными оболочками и слоями – уменьшение энергии ионизации атомов в подгруппе .
2) эффект проникновения внешних электронов к ядру. Согласно квантовой механике вероятность нахождения электрона в других слоях кроме «своего» не равна нулю. Этот эффект ведет к упрочнению связи электрона с ядром, т.е. к росту энергии ионизации, (самые проникающие s-электроны, менее – p и еще менее –d).
3) отталкивание электронов одного слоя, особенно находящихся на одной орбитали – уменьшение энергии ионизации.
Закономерности в их изменении по периодам и группам периодической системы:
|
из
5.00
|
Обсуждение в статье: Относительная сила кислот и оснований (схема Косселя) на примерах |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

