 |
Главная |
Гидролизом называются обменные реакции растворенных веществ с водой. Необратимый гидролиз – это гидролиз, идущий с образованием нерастворимых или газообразных веществ.
|
из
5.00
|
Некоторые соли, образованные катионом слабого нерастворимого основания или амфотерного гидроксида и анионом слабой неустойчивой, летучей или нерастворимой кислоты, в водном растворе не существуют. Они разлагаются водой с образованием гидроксида металла или основной соли и летучей или нерастворимой кислоты.
Бинарные соединения металлов (нитриды, силициды, карбиды, фосфиды) необратимо гидролизуются водой, образуя летучее водородное соединение неметалла и гидроксида металла:
Li3N + 3H2O = NH3↑ + 3LiOH
Ca2Si + 4H2O = SiH4↑ + 2Ca(OH)2
Многие бинарные соединения неметаллов в водном растворе полностью гидролизуются с образованием кислородсодержащей кислоты и бескислородной кислоты:
PCl3 + 3H2O = H3PO4 + 3HCl↑
SiS2 + 3H2O = H2SiO3 + 2H2S↑
49. Гидролиз солей одновременно по катиону и аниону (обратимый гидролиз). Расчет константы гидролиза, степени гидролиза и рН растворов таких солей на примере…
Соль слабой кислоты и слабого основания. Здесь в обменной реакции с водой участвуют и катионы и анионы. Гидролиз имеет место и по катиону, и по аниону одновременно; рН может быть равно 7, может быть <7, может быть ˃7. Это зависит от величин констант диссоциации кислоты и щелочи. Чья константа диссоциации больше – та и реакция.
Общий вид гидролиза по катиону и аниону одновременно:
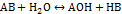
Тогда константа гидролиза: 
Если умножить числитель и знаменатель на  , то получим:
, то получим: 
Произведение  дает нам константу ионного произведения воды – КW, дробь
дает нам константу ионного произведения воды – КW, дробь 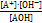 - это константа диссоциации основания
- это константа диссоциации основания 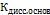 , а дробь
, а дробь 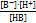 - это константа диссоциации кислоты
- это константа диссоциации кислоты  . Таким образом мы получаем:
. Таким образом мы получаем:

Степень гидролиза (  ) равна отношению числа гидролизованных молекул к общему числу растворенных молекул. При гидролизе по катиону и аниону одновременно
) равна отношению числа гидролизованных молекул к общему числу растворенных молекул. При гидролизе по катиону и аниону одновременно  очень большая. Чем слабее кислота (или основание), тем больше степень гидролиза.
очень большая. Чем слабее кислота (или основание), тем больше степень гидролиза.
 В : А+ ↔ В- (электростатическое притяжение). Это ионная связь. Строго говоря, соединения с чисто ионной связью нет. Самый частый тип связи – полярная ковалентная. В этом случае общая электронная пара смещена к одному из атомов в соответствии с их электроотрицательностью. ЭО – это суммарная хар-ка способности атома отдавать и присоединять электроны. ЭО сами по себе не очень важны, важны ΔЭО. Чем больше ΔЭО, тем полярнее (ионнее) связь.
Смещение электронной плотности при образовании полярной ков. связи можно учесть, приписав атомам эффективные заряды в единицах заряда электрона (δ,+δ, -δ). Это условные величины, т.к. электрон нельзя “разделить” между атомами. Эффективные заряды определяют экспериментально и они позволяют представить полярную ковалентную связь комбинацией “чисто” ковалентной и “чисто” ионной связей.
Если связь “чисто” ковалентная, то δ=0, если ионная, то δ = ±1 (однократная), δ=±2 (двухкратная связь) и т.п.
А для полярной ковалентной связи – промежуточные значения. пример Н+0,2∙∙∙Cl-0,2 0,8*0+0,2*1 (80% ковалентной связи и 20% ионной). Так даже у CsF δ= ±0,99, значит «чисто» ионных соединений нет!
Дипольный момент связи (μ) А∙∙∙В равен произведению эффективного заряда на расстояние между ядрами атомов: μ = δ ∙ d. Дипольный момент молекулы равен векторной сумме дипольных моментов связей с учетом неподеленных электронных пар. Единица μ – один Дебай (1Д), 1Д=3,3∙10-30Кл*м.
Обычно μ трудно предсказать, т.к. δ и d изменяются противоположно. Например: HF; HCl; HBr: падение δ (μ падает); CsF; CsCl; CsBr: рост d (μ растет).
Что важно – чем симметричнее молекула, тем меньше ее μ, например симметричные молекулы (CO2; BCl3; CCl4; PCl5; SF6) неполярны и имеют μ=0.
29 . Закон Гесса, условия его выполнения. Энтальпия образования, сгорания, атомизации(определение).
Закон Гесса: Энтальпия процесса зависит только от вида и состояния исходных веществ и конечных продуктов, но не зависит от пути перехода.
Закон выполняется при постоянном р или V
Стандартное состояние в-ва, находящегося в конденсированной фазе (тв,ж) – это состояние в-ва при данной температуре Т и давлении 1 атм.
∆Нобр0 – стандартная энтальпия образования. Это изменение энтальпии в процессе образования 1 моль данного в-ва, находящегося в стандартном состоянии, из простых в-в, также находящихся в стандартном состоянии, причем простые в-ва находятся в наиболее термодинамически устойчивом состоянии при данной температуре.
∆Нсгор0 – стандартная энтальпия сгорания. Это изменение энтальпии в процессе сгорания 1 моль в-ва с образованием СО2 (г), Н2О (ж) (если в составе в-ва есть водород или углерод) и других в-в, состав которых должен быть специально указан, причем все ингридиенты процесса находятся в стандартном состоянии.
Атомизация-энергия энергетического эффекта превращения 1 моля простого вещества в состояния свободных и взаимодействующих друг с другом ионов.
32. Энтальпия и энергия Гиббса, их физический смысл, связь между ними.
Физ смысл энтальпии – тепловой эффект реакции, измеренный при изобарных изотермических условиях
Физ смысл энергии Гиббса – так же как и в механике причиной самопроизвольного течения х р является стремление системы к достижению минимальной энергии Гиббса. Убыль этой энергии определяется работой х р и не зависит от пути, по которому идет эта реакция, а зависит от энергии Гиббса в начальном и конечном состояниях
Энергия гиббса меньше нуля – реакция идет самопроизвольно, энергия гиббса больше нуля – реакция идет при определенных условиях
H<0 экзотермическая
H>0 эндотермическая
33. Энергия Гиббса, как термодинамическая функция состояния. Определение и свойства. Вычисление стандартной энергии Гиббса процесса по справочным данным. Критерий самопроизвольного протекания реакций.
G – функция состояния системы, называемая энергией Гиббса. Она равна разности энтальпии и произведения энтропии на температуру: G=H – T∙S
Абсолютное значение G определить невозможно.
∆G=∆Н – Т∙∆S
Рассчитывают ∆G также, как и ∆Н, используя стандартные энергии Гиббса образования веществ ∆Gобр0.
∆Gреак0=∑(∆Gобр0)кон – ∑(∆Gобр0)исх
Свойства функции: 1)однозначная, конечная, непрерывная функция состояния системы; 2)обладает св-вом независимости ΔG от пути перехода от начальных в-в к продуктам. 3)-Aпол>G2-G1=ΔG А значит ΔG для обратимого процесса равно полезной работе системы. Физический смысл энергии Гиббса вытекает из со отношения: -Aпол=U2+pV2-TS2-(U1-pV1-TS1) – энергия Гиббса в равновесном процессе с точностью до знака равна полезной работе, которую может совершить система. В случае протекания неравновесных процессов энергия Гиббса будет (с обратным знаком) равна максимально возможной полезной работе, которую может совершить система.
Критерий самопроизвольного протекания в любых системах: “В системах, находящихся при р,Т=const, самопроизвольно могут протекать только процессы, сопровождающиеся уменьшением энергии Гиббса (∆G<0)”. При достижении равновесия в системе G=const.
3 6. Химическое равновесие. Принцип Ле-Шателье – Брауна и смещение равновесия. Рассмотрите на примере реакции…
Равновесным состоянием называется такое термодинамическое состояние системы, которое не изменяется во времени, причем эта неизменяемость не обусловлена протеканием какого-либо внешнего процесса.
Влияние изменения внешних условий на равновесие, определяется правилом – принцип Ле Шателье – Брауна:
“Если на систему, находящуюся в истинном равновесии, воздействовать извне, изменяя какое-либо из условий, определяющих положение равновесия, то в системе усилится то из направлений процесса, течение которого ослабляет влияние произведенного воздействия, и положение равновесия сместится в том же направлении.”
Принцип Ле Шателье – Брауна справедлив для любых равновесий ( и химических, и физических), но только истинных, кажущиеся равновесия этому принципу не подчиняются. Если воздействовать на кажущиеся равновесия, пытаясь их вывести из этого состояния, то они будут смещаться только в одном направлении, только в направлении достижения истинного равновесия, независимо от того, как будете воздействовать на это кажущееся равновесие.
39. Принципы построения шкалы стандартных термодинамических функций образования ионов в водных растворах. Как определить стандартную энтальпию образования … в водном растворе?
Ни одна характеристика иона объективно не может быть определена. Единственный выход – отсчитывать величины от чего-то. При этом электролит должен быть полностью диссоциированным. А такое возможно только в бесконечно разбавленных р-рах. Это такой р-р, в котором 1 моль р-ного в-ва приходится на бесконечно большое число молей р-ля. Его характеристики: 1)все электролиты полностью диссоциированы. 2) взаимодействие между ионами полностью отсутствуют. Именно для таких р-ров построена шкала стандартных термодинамических функций образования ионов в водных р-рах. Она основана на постулатах: ΔНобр0Н+(р-р, ст.с)=0; ΔGобр0Н+(р-р, ст.с)=0 S0Н+(р-р, ст.с)=0 На основе этого получаем: ΔНобр0НCl(р-р, ст.с)=ΔНобр0Н+(р-р, ст.с)+ΔНобр0Cl-(р-р, ст.с)= ΔНобр0Cl- (р-р, ст.с) Нашли ΔНобр0Cl- (р-р, ст.с), затем находим ΔНобр0NaCl (р-р, ст.с), а по ней - ΔНобр0Na+ (р-р, ст.с) и т.д. Получаем шкалу энтальпий образования ионов. А как нашли ΔНобр0НCl(р-р, ст.с)? ½ Н2(г) + ½ Cl2(г) + ∞Н2О(ж)=НCl (½ Н2(г) + ½ Cl2(г))= ΔНобр0НCl(г) ----->HCl(г)----(+ ∞Н2О(ж)= ΔНраств0НCl(г))---->HCl Получили: ΔНобр0НCl(р-р, ст.с)= ΔНобр0НCl(г)+ ΔНраств0НCl(г) А как нашли последнюю величину? ΔНобр0НCl(р-р, HCl*nH2O)= ΔНобр0НCl(г)+ ΔНраств0НCl(г) с образованием р-ра состава HCl*nH2O. А налогичным путем были найдены стандартные энергии Гиббса образования ионов и стандартные энтропии ионов. В отличие от энтропий реального в-ва, значение которого всегда только положительно, энтропии ионов могут быть и отрицательными, поскольку они – относительные величины.
41. Равновесие диссоциации воды. Ионное произведение воды. Шкалы величин рН и рОН.
Вода диссоциирует крайне незначительно 2Н2О↔Н3О+ + ОН- Для простоты вместо гидроксония используют негидратированный ион Н+, т.к. это не влияет на последующие выводы. Кw=[Н+][ОН-] Замена активностей ионов на концентрации оправдана тем, что вода диссоциирует в очень незначительной степени. Действительно, при 298,15К концентр ация ионов Н+ и ОН- в воде составляет 1*10-7моль/л (из 555 миллионов молекул воды диссоциирует лишь одна). ΔG0процесса=ΔG0обрН++ΔG0обрОН--ΔG0обрН2О(ж)=0 – 157,32 - ( -237,25) = 79,93 кДж Кw=eΔGпроцесса/RT=1,0*10-14 [Н+][ОН-]=1,0*10-14 lg[Н+] + lg[ОН-]=-14 -lg[Н+] - lg[ОН-]=14 рН=-lg[Н+];
рОН=- lg[ОН-] Для любого водного р-ра при 298,15К: рН+ рОН=14 В воде в соответствии с уравнением ее диссоциации соответственно рН=рОH=7, это нейтральная среда. В кислых растворах [Н+]>10-7моль/л и рН<7 (рОН>7). В щелочных растворах [Н+]<10-7моль/л и рН>7 (рОН<7). Например, сильной к-ты, зная ее См НА↔Н++А- [Н+]=[НА]=Ск-ты рН=-lg[Н+]
45. Условия выпадения осадка и растворения малорастворимых электролитов. Связь ПР с растворимостью на примере…
KtnAm(k)↔ KtnAm↔ nKtm++mAn- насыщ.р-р насыщ.р-р В водных растворах все малорастворимые электролиты не ассоциированы. Другими словами, средняя стадия написанного равновесия отсутствует. KtnAm(k) ↔ nKtm++mAn- Соответствующая константа равновесия с учетом того, что концентрация индивидульаного кристаллического в-ва равна единице, принимает вид: Kравн=[Ktm+]n∙[An-]m= произведение растворимости (ПР) Таким образом, произведение растворимости (ПР) есть константа равновесия растворения и диссоциации малорастворимого электролита. Оно численно равно произведению концентраций(активностей) ионов в степенях стехиометрических коэффициентов в насыщенном водном растворе данного малорастворимого электролита. ПК=[Ktm+]n∙[An-]m. ПК – произведение концентраций. Для выпадения осадка необходимо ΔG>0, отсюда получаем: (-RTlnПР+RTlnПК)>0 RTlnПК>RTlnПР ПК>ПР Если ПК>ПР – выпадет осадок, ПК<ПР -осадок растворится, ПК=ПР -установится равновесие.
46. Произведение растворимости, как константа равновесия растворения и диссоциации малорастворимого соединения. Связь ПР с растворимостью на примере…
KtnAm(k)↔ KtnAm↔ nKtm++mAn- насыщ.р-р насыщ.р-р В водных растворах все малорастворимые электролиты не ассоциированы. Другими словами, средняя стадия написанного равновесия отсутствует. KtnAm(k) ↔ nKtm++mAn- Соответствующая константа равновесия с учетом того, что концентрация индивидульаного кристаллического в-ва равна единице, принимает вид: Kравн=[Ktm+]n∙[An-]m= произведение растворимости (ПР) Таким образом, произведение растворимости (ПР) есть константа равновесия растворения и диссоциации малорастворимого электролита. Оно численно равно произведению концентраций(активностей) ионов в степенях стехиометрических коэффициентов в насыщенном водном растворе данного малорастворимого электролита. [Ktm+]= nP; [An-]=mP ПР = [Ktm+]n∙[An-]m = (nP)n(mP)m Если ПК>ПР – выпадет осадок, ПК<ПР -осадок растворится, ПК=ПР -установится равновесие. ПК=[Ktm+]n∙[An-]m. ПК – произведение концентраций. 50. Гидролиз солей по катиону. Способы подавления гидролиза, степени гидролиза и рН растворов солей, гидролизованных по катиону на примере…
Общий вид гидролиза по катиону:
В : А+ ↔ В- (электростатическое притяжение). Это ионная связь. Строго говоря, соединения с чисто ионной связью нет. Самый частый тип связи – полярная ковалентная. В этом случае общая электронная пара смещена к одному из атомов в соответствии с их электроотрицательностью. ЭО – это суммарная хар-ка способности атома отдавать и присоединять электроны. ЭО сами по себе не очень важны, важны ΔЭО. Чем больше ΔЭО, тем полярнее (ионнее) связь.
Смещение электронной плотности при образовании полярной ков. связи можно учесть, приписав атомам эффективные заряды в единицах заряда электрона (δ,+δ, -δ). Это условные величины, т.к. электрон нельзя “разделить” между атомами. Эффективные заряды определяют экспериментально и они позволяют представить полярную ковалентную связь комбинацией “чисто” ковалентной и “чисто” ионной связей.
Если связь “чисто” ковалентная, то δ=0, если ионная, то δ = ±1 (однократная), δ=±2 (двухкратная связь) и т.п.
А для полярной ковалентной связи – промежуточные значения. пример Н+0,2∙∙∙Cl-0,2 0,8*0+0,2*1 (80% ковалентной связи и 20% ионной). Так даже у CsF δ= ±0,99, значит «чисто» ионных соединений нет!
Дипольный момент связи (μ) А∙∙∙В равен произведению эффективного заряда на расстояние между ядрами атомов: μ = δ ∙ d. Дипольный момент молекулы равен векторной сумме дипольных моментов связей с учетом неподеленных электронных пар. Единица μ – один Дебай (1Д), 1Д=3,3∙10-30Кл*м.
Обычно μ трудно предсказать, т.к. δ и d изменяются противоположно. Например: HF; HCl; HBr: падение δ (μ падает); CsF; CsCl; CsBr: рост d (μ растет).
Что важно – чем симметричнее молекула, тем меньше ее μ, например симметричные молекулы (CO2; BCl3; CCl4; PCl5; SF6) неполярны и имеют μ=0.
29 . Закон Гесса, условия его выполнения. Энтальпия образования, сгорания, атомизации(определение).
Закон Гесса: Энтальпия процесса зависит только от вида и состояния исходных веществ и конечных продуктов, но не зависит от пути перехода.
Закон выполняется при постоянном р или V
Стандартное состояние в-ва, находящегося в конденсированной фазе (тв,ж) – это состояние в-ва при данной температуре Т и давлении 1 атм.
∆Нобр0 – стандартная энтальпия образования. Это изменение энтальпии в процессе образования 1 моль данного в-ва, находящегося в стандартном состоянии, из простых в-в, также находящихся в стандартном состоянии, причем простые в-ва находятся в наиболее термодинамически устойчивом состоянии при данной температуре.
∆Нсгор0 – стандартная энтальпия сгорания. Это изменение энтальпии в процессе сгорания 1 моль в-ва с образованием СО2 (г), Н2О (ж) (если в составе в-ва есть водород или углерод) и других в-в, состав которых должен быть специально указан, причем все ингридиенты процесса находятся в стандартном состоянии.
Атомизация-энергия энергетического эффекта превращения 1 моля простого вещества в состояния свободных и взаимодействующих друг с другом ионов.
32. Энтальпия и энергия Гиббса, их физический смысл, связь между ними.
Физ смысл энтальпии – тепловой эффект реакции, измеренный при изобарных изотермических условиях
Физ смысл энергии Гиббса – так же как и в механике причиной самопроизвольного течения х р является стремление системы к достижению минимальной энергии Гиббса. Убыль этой энергии определяется работой х р и не зависит от пути, по которому идет эта реакция, а зависит от энергии Гиббса в начальном и конечном состояниях
Энергия гиббса меньше нуля – реакция идет самопроизвольно, энергия гиббса больше нуля – реакция идет при определенных условиях
H<0 экзотермическая
H>0 эндотермическая
33. Энергия Гиббса, как термодинамическая функция состояния. Определение и свойства. Вычисление стандартной энергии Гиббса процесса по справочным данным. Критерий самопроизвольного протекания реакций.
G – функция состояния системы, называемая энергией Гиббса. Она равна разности энтальпии и произведения энтропии на температуру: G=H – T∙S
Абсолютное значение G определить невозможно.
∆G=∆Н – Т∙∆S
Рассчитывают ∆G также, как и ∆Н, используя стандартные энергии Гиббса образования веществ ∆Gобр0.
∆Gреак0=∑(∆Gобр0)кон – ∑(∆Gобр0)исх
Свойства функции: 1)однозначная, конечная, непрерывная функция состояния системы; 2)обладает св-вом независимости ΔG от пути перехода от начальных в-в к продуктам. 3)-Aпол>G2-G1=ΔG А значит ΔG для обратимого процесса равно полезной работе системы. Физический смысл энергии Гиббса вытекает из со отношения: -Aпол=U2+pV2-TS2-(U1-pV1-TS1) – энергия Гиббса в равновесном процессе с точностью до знака равна полезной работе, которую может совершить система. В случае протекания неравновесных процессов энергия Гиббса будет (с обратным знаком) равна максимально возможной полезной работе, которую может совершить система.
Критерий самопроизвольного протекания в любых системах: “В системах, находящихся при р,Т=const, самопроизвольно могут протекать только процессы, сопровождающиеся уменьшением энергии Гиббса (∆G<0)”. При достижении равновесия в системе G=const.
3 6. Химическое равновесие. Принцип Ле-Шателье – Брауна и смещение равновесия. Рассмотрите на примере реакции…
Равновесным состоянием называется такое термодинамическое состояние системы, которое не изменяется во времени, причем эта неизменяемость не обусловлена протеканием какого-либо внешнего процесса.
Влияние изменения внешних условий на равновесие, определяется правилом – принцип Ле Шателье – Брауна:
“Если на систему, находящуюся в истинном равновесии, воздействовать извне, изменяя какое-либо из условий, определяющих положение равновесия, то в системе усилится то из направлений процесса, течение которого ослабляет влияние произведенного воздействия, и положение равновесия сместится в том же направлении.”
Принцип Ле Шателье – Брауна справедлив для любых равновесий ( и химических, и физических), но только истинных, кажущиеся равновесия этому принципу не подчиняются. Если воздействовать на кажущиеся равновесия, пытаясь их вывести из этого состояния, то они будут смещаться только в одном направлении, только в направлении достижения истинного равновесия, независимо от того, как будете воздействовать на это кажущееся равновесие.
39. Принципы построения шкалы стандартных термодинамических функций образования ионов в водных растворах. Как определить стандартную энтальпию образования … в водном растворе?
Ни одна характеристика иона объективно не может быть определена. Единственный выход – отсчитывать величины от чего-то. При этом электролит должен быть полностью диссоциированным. А такое возможно только в бесконечно разбавленных р-рах. Это такой р-р, в котором 1 моль р-ного в-ва приходится на бесконечно большое число молей р-ля. Его характеристики: 1)все электролиты полностью диссоциированы. 2) взаимодействие между ионами полностью отсутствуют. Именно для таких р-ров построена шкала стандартных термодинамических функций образования ионов в водных р-рах. Она основана на постулатах: ΔНобр0Н+(р-р, ст.с)=0; ΔGобр0Н+(р-р, ст.с)=0 S0Н+(р-р, ст.с)=0 На основе этого получаем: ΔНобр0НCl(р-р, ст.с)=ΔНобр0Н+(р-р, ст.с)+ΔНобр0Cl-(р-р, ст.с)= ΔНобр0Cl- (р-р, ст.с) Нашли ΔНобр0Cl- (р-р, ст.с), затем находим ΔНобр0NaCl (р-р, ст.с), а по ней - ΔНобр0Na+ (р-р, ст.с) и т.д. Получаем шкалу энтальпий образования ионов. А как нашли ΔНобр0НCl(р-р, ст.с)? ½ Н2(г) + ½ Cl2(г) + ∞Н2О(ж)=НCl (½ Н2(г) + ½ Cl2(г))= ΔНобр0НCl(г) ----->HCl(г)----(+ ∞Н2О(ж)= ΔНраств0НCl(г))---->HCl Получили: ΔНобр0НCl(р-р, ст.с)= ΔНобр0НCl(г)+ ΔНраств0НCl(г) А как нашли последнюю величину? ΔНобр0НCl(р-р, HCl*nH2O)= ΔНобр0НCl(г)+ ΔНраств0НCl(г) с образованием р-ра состава HCl*nH2O. А налогичным путем были найдены стандартные энергии Гиббса образования ионов и стандартные энтропии ионов. В отличие от энтропий реального в-ва, значение которого всегда только положительно, энтропии ионов могут быть и отрицательными, поскольку они – относительные величины.
41. Равновесие диссоциации воды. Ионное произведение воды. Шкалы величин рН и рОН.
Вода диссоциирует крайне незначительно 2Н2О↔Н3О+ + ОН- Для простоты вместо гидроксония используют негидратированный ион Н+, т.к. это не влияет на последующие выводы. Кw=[Н+][ОН-] Замена активностей ионов на концентрации оправдана тем, что вода диссоциирует в очень незначительной степени. Действительно, при 298,15К концентр ация ионов Н+ и ОН- в воде составляет 1*10-7моль/л (из 555 миллионов молекул воды диссоциирует лишь одна). ΔG0процесса=ΔG0обрН++ΔG0обрОН--ΔG0обрН2О(ж)=0 – 157,32 - ( -237,25) = 79,93 кДж Кw=eΔGпроцесса/RT=1,0*10-14 [Н+][ОН-]=1,0*10-14 lg[Н+] + lg[ОН-]=-14 -lg[Н+] - lg[ОН-]=14 рН=-lg[Н+];
рОН=- lg[ОН-] Для любого водного р-ра при 298,15К: рН+ рОН=14 В воде в соответствии с уравнением ее диссоциации соответственно рН=рОH=7, это нейтральная среда. В кислых растворах [Н+]>10-7моль/л и рН<7 (рОН>7). В щелочных растворах [Н+]<10-7моль/л и рН>7 (рОН<7). Например, сильной к-ты, зная ее См НА↔Н++А- [Н+]=[НА]=Ск-ты рН=-lg[Н+]
45. Условия выпадения осадка и растворения малорастворимых электролитов. Связь ПР с растворимостью на примере…
KtnAm(k)↔ KtnAm↔ nKtm++mAn- насыщ.р-р насыщ.р-р В водных растворах все малорастворимые электролиты не ассоциированы. Другими словами, средняя стадия написанного равновесия отсутствует. KtnAm(k) ↔ nKtm++mAn- Соответствующая константа равновесия с учетом того, что концентрация индивидульаного кристаллического в-ва равна единице, принимает вид: Kравн=[Ktm+]n∙[An-]m= произведение растворимости (ПР) Таким образом, произведение растворимости (ПР) есть константа равновесия растворения и диссоциации малорастворимого электролита. Оно численно равно произведению концентраций(активностей) ионов в степенях стехиометрических коэффициентов в насыщенном водном растворе данного малорастворимого электролита. ПК=[Ktm+]n∙[An-]m. ПК – произведение концентраций. Для выпадения осадка необходимо ΔG>0, отсюда получаем: (-RTlnПР+RTlnПК)>0 RTlnПК>RTlnПР ПК>ПР Если ПК>ПР – выпадет осадок, ПК<ПР -осадок растворится, ПК=ПР -установится равновесие.
46. Произведение растворимости, как константа равновесия растворения и диссоциации малорастворимого соединения. Связь ПР с растворимостью на примере…
KtnAm(k)↔ KtnAm↔ nKtm++mAn- насыщ.р-р насыщ.р-р В водных растворах все малорастворимые электролиты не ассоциированы. Другими словами, средняя стадия написанного равновесия отсутствует. KtnAm(k) ↔ nKtm++mAn- Соответствующая константа равновесия с учетом того, что концентрация индивидульаного кристаллического в-ва равна единице, принимает вид: Kравн=[Ktm+]n∙[An-]m= произведение растворимости (ПР) Таким образом, произведение растворимости (ПР) есть константа равновесия растворения и диссоциации малорастворимого электролита. Оно численно равно произведению концентраций(активностей) ионов в степенях стехиометрических коэффициентов в насыщенном водном растворе данного малорастворимого электролита. [Ktm+]= nP; [An-]=mP ПР = [Ktm+]n∙[An-]m = (nP)n(mP)m Если ПК>ПР – выпадет осадок, ПК<ПР -осадок растворится, ПК=ПР -установится равновесие. ПК=[Ktm+]n∙[An-]m. ПК – произведение концентраций. 50. Гидролиз солей по катиону. Способы подавления гидролиза, степени гидролиза и рН растворов солей, гидролизованных по катиону на примере…
Общий вид гидролиза по катиону:
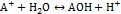 Тогда константа гидролиза:
Тогда константа гидролиза:  Если умножить числитель и знаменатель на
Если умножить числитель и знаменатель на  , то получим:
, то получим: 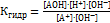 Произведение
Произведение  дает нам константу ионного произведения воды – КW, а дробь
дает нам константу ионного произведения воды – КW, а дробь 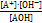 - это константа диссоциации основания
- это константа диссоциации основания 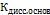 . Таким образом мы получаем:
. Таким образом мы получаем:  Степень гидролиза (
Степень гидролиза (  ) равна отношению числа гидролизованных молекул к общему числу растворенных молекул. При гидролизе по катиону
) равна отношению числа гидролизованных молекул к общему числу растворенных молекул. При гидролизе по катиону  не велика. Чем слабее кислота (или основание), тем больше степень гидролиза.
не велика. Чем слабее кислота (или основание), тем больше степень гидролиза.
19. Основные положения метода молекулярных орбиталей (МО ЛКАО). Объясните парамагнитные свойства… и найдите кратность связи в … и …
Основные положения метода МО:
1) При соединении двух атомов в молекулу возможны два состояния – две МО: с более низкой энергией (Есвяз) и более высокой энергией (Еразр). Переход электрона на первую орбиталь ведёт к образованию связи, а на вторую – не даёт. Если атомная орбиталь “переселяется” в молекулу без изменений энергии, она наз. несвязывающей.
2) Метод МО учитывает вклад в хим. связь отдельных е.
3) В первом приближении один электрон на разрыхляющей орбитали сводит на нет действие одного связывающего электрона. Отсюда кратность связи равна полуразности числа связывающих и разрыхляющих электронов.
|
из
5.00
|

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

