 |
Главная |
Химическое равновесие. Истинное (устойчивое) и кажущееся (кинетическое) равновесия, их признаки. Приведите примеры.
|
из
5.00
|
"Равновесным состоянием называется такое термодинамическое состояние системы, которое не изменяется во времени, причем эта неизменность не обусловлена протеканием какого-либо внешнего процесса".
Различают истинное и кажущееся равновесие.
Признаки истинного равновесия:
1) Если нет внешнего воздействия, то система неизменна во времени
2) Система следует за любыми изменениями внешних условий, сколь угодно малыми они бы не были, а если воздействие снято, то система возвращается в исходное состояние равновесия.
3) Состояние системы будет одинаковым независимо от того, с какой стороны она подходит к равновесию.
Кажущееся равновесие также неизменно во времени при отсутствии внешнего воздействия, однако 2 и 3 признаки для него не характерны.
38. Равновесие диссоциации ассоциированных (слабых) электролитов на примере… Степень диссоциации, константа диссоциации. Закон разбавления Оствальда..
Электролитическая диссоциация – химически обратимый процесс, следовательно, можно написать выражение для равновесия диссоциации:
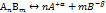 . Отсюда константа диссоциации:
. Отсюда константа диссоциации: 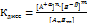
В выражении константы диссоциации все концентрации обязательно равновесные.
Слабые электролиты существуют в растворе как в виде простых ионов, так и частично в виде недиссоциированных молекул.
Для слабого электролита можно записать:
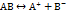 .
.
Обозначим исходную концентрацию электролита через С, тогда константа диссоциации:
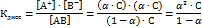
В случае очень слабого электролита (« 0,01) зависимость между Кдисс и а становится еще проще:
Кдисс = Саг
Это уравнение называется законом разбавления Оствальда. Оно дает зависимость степени диссоциации от концентрации раствора. Эта константа называется “условной”. Так как если мы будем им пользоваться, изучая равновесие одной системы, но при разных концентрациях раствора, то выяснится, что эта константа диссоциации не совсем константа. Числовые значения константы диссоциации для разных концентрации раствора будут несколько различаться. Это легко объяснить, если вспомнить что мы имеем дело с реальными растворами, которыми идеальными не являются. Истинная константа диссоциации, которая будет являться константой при любых концентрациях выглядит, так:
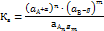
Равновесие диссоциации комплексных соединений. Константа устойчивости и константа нестойкости. Реакции образования комплексных соединений. Приведите примеры получения гидроксокомплекса, амминокомплекса и ацидокомплекса.
Донорно-акцепторная связь в комплексных соединениях является весьма прочной, однако наряду с диссоциацией, в которой отщепляются ионы внешней сферы, в очень незначительной степени разрушается также внутренняя сфера комплекса:
[Ag(NH3)2]Cl ® [Ag(NH3)2]+ + Cl– (первичная диссоциация)
[Ag(NH3)2]+ ↔Ag+ + 2 NH3 (вторичная диссоциация)
Вторичная диссоциация подчиняется закону действия масс и характеризуется соответствующей константой равновесия , которая называется константой нестойкости комплексного иона: 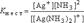
Чем меньше значение Кн, тем более устойчивой является внутренняя сфера комплексного соединения, то есть – тем меньше она диссоциирует в водном растворе. В последнее время вместо Кн используют значение константы устойчивости (Ку). Чем больше значение Ку, тем более стабильный комплекс.
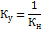
Способность к образованию комплексов всего сильнее проявляют элементы Cu, Ni, Co, Fe, Mn, Zn, Ag и т. д.
Общим методом получения комплексов типа присоединения является действие избытка комплексообразующего реагента на соли связываемого в комплекс иона. Например,
HgCl2 + 4KI = K2[HgI4] + 2KCl
Таким способом получают галогено-, родано-, циано-, нитро-, киcлородсодержащие и другие комплексные соединения.
Общим методом получения комплексов, образующихся по типу внедрения, является действие аммиака или воды на соли связываемого в комплекс иона. Например,
HgCl2 + 2NH4OH = [Ag(NH3)2]Cl + 2H2O
Так получают аммиакаты и аквакомплексы.
Получение:
а) ацидокомплекса:
B(OH)3 + 4KF = 3KOH + K[BF4]
CuCl + Cl- = [CuCl2]-
б) амминокомплекса:
[Cu(H2O)4]2+ + 4NH3 ↔ [Cu(NH3)4]2+ + 4H2O
в) гидроксокомплекса:
PbO + H2O + 2KOH --> K2[Pb(OH)4]
|
из
5.00
|
Обсуждение в статье: Химическое равновесие. Истинное (устойчивое) и кажущееся (кинетическое) равновесия, их признаки. Приведите примеры. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

