 |
Главная |
Атомные и ионные радиусы, как их определяют? Как изменяются радиусы в рядах:...
|
из
5.00
|
Атомные радиусы подразделяют на радиусы атомов металлов, ковалентные радиусы атомов металлов и радиусы атомов благородных газов. Их определяют как половину расстояния между слоями атомов в кристаллая соответствующих простых в-в. рентгенографическим или нейтронографичским методами.
радиус атома зависит не только от природы атомов, но и от характера химической связи между ними, агрегатного состояния, температуры и ряда других факторов. Это обстоятельство лишний раз указывает на относительность понятия «радиус атома». Атомы не являются несжижаемыми, неподвижно застывшими шариками, они всегда принимают участие во вращательном и колебательном движении.
Радиусы атомов благородных газов значительно больше радиусов атомов неметаллов соответствующих периодов, поскольку в кристаллах благородных газов межатомное взаимодействие очень слабое.
Шкала ионных радиусов, понятно, не может быть основана на тех же принципах, что шкала атомных радиусов (ни одна хар-ка индивидуального иона не может быть объективно определена). Современная шкала ионных радиусов основана на допущении, что границей между ионами является точка минимума электронной плотности на линии, соединяющей центры ионов.
10. Основные положения метода валентных связей при описании химической связи, валентные возможности атомов…
Основные положения метода валентных связей:
1) Образуют химическую связь два электрона с противоположными спинами; происходит перекрывание Ψ-функций и повышение электр. плотности между ядрами;
2) связь локализована в направлении максимального перекрывания Ψ-функций электронов;
3) чем сильнее перекрывание, тем прочнее связь;
4) валентность атома численно равна количеству неспаренных электронов на внешнем слое в основном состоянии или могут быть в возбужденном состоянии.
12,13,14. Гибридизация атомных орбиталей при описании химической связи. Варианты гибридизации с участием s p d орбиталей.
Гибридизация – математический прием, учитывающий выравнивание волновых функций е ( или др словами – выравнивание е орбиталей по форме и энергии), происходящей при образовании хим связи
Порядок определения геометрии молекулы: 1)составляют графическую формулу; 2) определяют у центрального атома наличие неподеленной е пары или неспаренных е 2)определяют число гибридных орбиталей, оно равно сумме числа сигма свзей (чило соседних атомов) и числа неподел. е пар 4) определ. тип гибридизации
sp – линейная 1800
sp2, d2s – правильный треугольник 1200
sp3,d3s- тетраэдр 109028’
dsp2 – расположение партнеров по вершинам квадрата относительно центрального атома (характерно для комплексных соединений).
dsp3,d2sp2,d4s – прав. тригональная пирамида
d2sp3,dsp3d,sp3d2 – октаэдр
d3pd3 – пентагональная бипирамида
Квантово-химические расчеты показывают, что более двух d-орбиталей использовать в гибридной комбинации невыгодно. Поэтому для описания семи и восьми одинаковых связей (например, в комплексах) привлекают в гибридные комбинации f-орбитали: d2sp3f и d2sp3f2.
15. Образование кратных связей. δ- и π- связи, их особенности
Основные положения метода валентных связей:
1) связь дают два электрона с противоположными спинами; происходит перекрывание Ψ - функций и повышение электр. плотности между ядрами;
2) связь сосредоточена в направлении максимального перекрывания Ψ - функций электронов;
3) валентность атома численно равна количеству неспаренных электронов на внешнем слое в основном состоянии или кол-ву неспаренных электронов, которые могут быть в возбужденном состоянии;
4) чем сильнее перекрывание, тем прочнее связь.
По характеру перекрывания орбиталей обычно выделяют σ - и π - связи. Связи, образованные электронными орбиталями, имеющими максимум зоны перекрывания на линии, соединяющей ядра, называются σ - связями.
Связи, образованные электронными орбиталями, дающими максимумы перекрывания по обе стороны от линии, соединяющей ядра, называются π - связями.
В подавляющем большинстве случаев π - связи менее прочные, чем σ - связи. В кратной связи только одна связь σ - типа, все остальные (одна или две) относятся к π - связям.
Закон эквивалентов. Различные формы записи закона (реакции в-в в растворах и газообразном состояние). Что такое нормальная концентрация и как она связана с молярной концентрацией ?
Эквивалент – условная или реальная частица вещества х, которая в данной кислотноосновной реакции эквивалентна иону Н+, а в ОВР эквивалентна электрону. Фактор эквивалентности – число, показывающее какая часть молекулы(моля) в-ва эквивалентна 1Н+ или 1 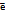 в данной реакции.
в данной реакции.
Закон эквивалентов: если реакция идет до конца, то кол-во эквивалентов в-ва, вступающих в реакцию и образующихся в результате реакции равны: А+В=С+D
nэкв(А)= nэкв(В)= nэкв(С)= nэкв(D)
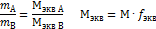
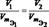
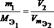
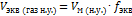
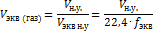
Нормальная концентрация показывает сколько моль-эквивалентов растворенного в-ва содержится в 1 литре раствора.
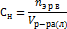
|
из
5.00
|
Обсуждение в статье: Атомные и ионные радиусы, как их определяют? Как изменяются радиусы в рядах:... |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

