 |
Главная |
Типичные окислители в ОВР. Каковы продукты их восстановления? Классификация ОВР. Приведите примеры.
|
из
5.00
|
Окислитель – вещество, молекулы или ионы которого принимают электроны. Типичные окислители:
1) в-ва, молекулы которых содержат атомы элементов в высших положительных степенях окисления, например: KMn+7O4, KBi+5O3, K2Cr2+6O7, Pb+4O2;
2) катионы металлов более высокого заряда (более высокой степени окисления), например: Fe+3; Au+3; Sn+4;
3) галогены и кислород (при повышенных температурах).
Классификация ОВР:
1) межмолекулярные ОВР – в этих реакциях окислителем и восстановителем являются разные молекулы.
2) внутримолекулярные ОВР – в этих реакциях окислителем восстановителем являются атомы различных или одиноковых элементов, находящихся в разных частях одной молекулы, например: (N-3H4)2Cr+62O7 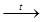 N02 + Cr+32O3 + 4H20.
N02 + Cr+32O3 + 4H20.
3) реакции диспропорционирования, в которых окислителем и восстановителем являются одни и те же атомы в молекуле: 3Cl02 + 6KOH 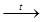 5KCl-1 + KCl+5O3 + 3H2O.
5KCl-1 + KCl+5O3 + 3H2O.
Продукты их восстановления: Если элемент является окислителем – его степень окисления понижается; если элемент является восстановителем – его степень окисления повышается. Среди простых веществ окислительные свойства характерны для типичных неметаллов (F2, Cl2, Br2, I2, O2, O3). Галогены, выступая в качестве окислителей, приобретают степень окисления –1, причем от фтора к иоду окислительные свойства ослабевают. Кислород, восстанавливаясь, приобретает степень окисления –2 (H2O или OH–).
Сложные вещества, используемые в качестве окислителей, очень часто, содержат элементы в высшей степени окисления. Например: KMn+7O4; K2Cr+62O7; HN+5O3; KCl+7O4. Концентрированная серная кислота проявляет окислительные свойства за счет серы в высшей степени окисления +6. Продуктами восстановления серы могут быть: SO2 (степень окисления серы +4), сера – простое вещество (степень окисления серы 0), сероводород (степень окисления серы –2).
Азотная кислота проявляет ок ислительные свойства за счет азота в высшей степени окисления +5, причем окислительная способность HNO3 усиливается с ростом ее концентрации. Состав продуктов восстановления азотной кислоты зависит от активности восстановителя, концентрации кислоты и температуры системы; чем активнее восстановитель и ниже концентрация кислоты, тем глубже происходит восстановление азота.
Водород в степени окисления +1 выступает как окислитель преимущественно в растворах кислот (как правило, при взаимодействии с металлами, расположенными в ряду напряжений до водорода).
Классификация комплексных соединений: по виду координированных лигандов, по заряду комплексного иона, по классам соединений. Номенклатура комплексных соединений. Приведите примеры.
Классификация комплексных соединений: по виду координируемых лигандов, по заряду комплексного иона, по классам соединений. Номенклатура комплексных соединений. Приведите примеры.
Классификация комплексных соединений:
1) по виду координируемых лигандов: +) аквакомплексы, в которых лигандом явл. молекула воды. Например: K2[Sn(OH)4], Na3[Cr(OH)6].
+) аммиачные комплексы: лиганды NH3 . Например: [Ag(NH3)2]Cl, [Cu(NH3)4](OH)2 .
+) ацидокомплексы, в которых лиганды – анионы кислотных остатков. Например: K[Au(CN)2], K2[HgI4].
2) по заряду комплексного иона: +) катионные – комплексы имеют катионные к/о. Например: [Co(NH3)6]Cl3
+) анионные – комплексы имеют анионные к/о. Например: K[PF6]
+) нейтральные – к/о не имеют заряда. Например: []
+) комплексы без внешней сферы, т.е внутрисферные к.с. Например: [Pt(NH3)2Cl2]
3) по классам соединений: +) кислотные комплексы. Например: H2[SiF6].
+) комплексы основания. Например: [Ag(NH3)2]OH.
+) комплексы соли. Например: K2[Fe(CN)6].
Простое объяснение механизма образования хим. связи – донорно-акцепторное. Лиганды поставляют свободные электронные пары на пустые d-орбитали к/о. Число координационных мест называется дентатностью (монодентатные, бидентатные и т.п.)
Координационные числа обычно в четные и равны удвоенной степени окисления к/о.
По характеру лигандов бывают аквакомплексы, гидроксокомплексы, аммиачные комплексы, ацидокомплексы (лиганды – анионы кислотных остатков). Бывают однородные, а бывают и с разными лигандами. Бывают комплексные соединения и без внешней сферы.
Названия комплексов строятся по принципу названий солей с указанием лигандов и степени окисления к/о. При построении названия компл. катиона или аниона первоначально называют ионные лиганды в порядке возрастания степени их сложности. При этом молекулы H2O и NH3 обозначаются “аква” и “аммин”. В конце названия компл. катиона или аниона наз. ион-к/о с указанием его степени окисления римскими цифрами в скобках. В случае аниона берется корень латинского названия элемента, к нему добавляется “ат” (станнат, аурат, плюмбат). Например: К3[Al(OH)6] - гексагидроксоалюминат (III) калия; [Cr(NH3)4Cl2]Cl – хлорид дихлоротетрамминхрома
37. Константа химического равновесия. Соотношение величин Кр и Кс для газовых равновесий. Связь ∆ G 0 хим.реакции и константы равновесия
Общий вид процесса: 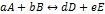 . Здесь строчными буквами обозначены стехиометрические коэффициенты, а прописными (A,B,D,E) – реагенты в этой химической реакции, в этом равновесии. Обозначим Сi равновесные концентрации, а через рi – равновесные парциальные давления. Тогда для раствора можно записать:
. Здесь строчными буквами обозначены стехиометрические коэффициенты, а прописными (A,B,D,E) – реагенты в этой химической реакции, в этом равновесии. Обозначим Сi равновесные концентрации, а через рi – равновесные парциальные давления. Тогда для раствора можно записать: 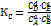 и точно также для газовой фазы:
и точно также для газовой фазы: 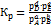 .
.
Здесь Кс и Кр – константы химического равновесия.
Существует соотношение между константой равновесия и величиной ∆G0хим.реакции соответствующего химического процесса: 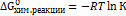
После пересчета натурального логарифма в десятичный и выражения в калориях величины R получаем: 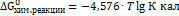
40. Шкалы величин рН и рОН. Вычисление рН растворов неассоциированных электролитов на примерах…
Вода диссоциирует крайне незначительно 2Н2О↔Н3О+ + ОН-
Для простоты вместо гидроксония используют негидратированный ион Н+, т.к. это не влияет на последующие выводы.
Кw=[Н+][ОН-]
Замена активностей ионов на концентрации оправдана тем, что вода диссоциирует в очень незначительной степени. Действительно, при 298,15К концентр ация ионов Н+ и ОН- в воде составляет 1*10-7моль/л (из 555 миллионов молекул воды диссоциирует лишь одна).
ΔG0процесса=ΔG0обрН++ΔG0обрОН--ΔG0обрН2О(ж)=0 – 157,32 - ( -237,25) = 79,93 кДж
Кw=eΔGпроцесса/RT=1,0*10-14
[Н+][ОН-]=1,0*10-14
lg[Н+] + lg[ОН-]=-14 -lg[Н+] - lg[ОН-]=14
рН=-lg[Н+]; рОН=- lg[ОН-]
Для любого водного р-ра при 298,15К: рН+ рОН=14
В воде в соответствии с уравнением ее диссоциации соответственно рН=рОH=7, это нейтральная среда. В кислых растворах [Н+]>10-7моль/л и рН<7 (рОН>7). В щелочных растворах [Н+]<10-7моль/л и рН>7 (рОН<7).
Например, сильной к-ты, зная ее См
НА↔Н++А-
[Н+]=[НА]=Ск-ты
рН=-lg[Н+]
43.Буферные растворы и их свойства. Расчет рН буферного раствора состава…
Буферные растворы – растворы с постоянным значением рН, не зависящем от разбавления и почти независящем от небольших добавок сильных кислот или щелочей.
Буферные растворы представляют собой смешанные растворы слабой кислоты с ее солью или слабого основания с его солью. Например, раствор смеси уксусной кислоты и ацетата натрия (CH3COOH + CH3COONa). Константа диссоциации уксусной кислоты в растворе, когда в нем находится только уксусная кислота: 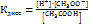
Если в раствор уксусной кислоты добавить ацетат натрия, эта соль диссоциирует, больше, чем уксусная кислота. Приближенно можно считать, что ацетат натрия в растворе диссоциирует нацело и (по принципу Ле Шателье) подавляет диссоциацию уксусной кислоты.
Концентрация водородных ионов равна:
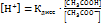
В случае добавления в раствор ацетата натрия, диссоциация уксусной кислоты подавлена и ее концентрация приближенно равна исходной концентрации кислоты, а концентрация иона СН3СОО- приближенно равна исходной концентрации добавленной соли:
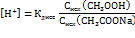
т.е. величина рН буферного раствора определяется отношением концентрации кислоты и соли в растворе. При разбавлении раствора его рН практически не изменится, так как отношение Ск-ты к Ссоли останется постоянным. Прибавление небольших количеств сильной кислоты или щелочи тоже мало изменит величину рН, так как ионы Н+ и ОН- будут связываться и, таким образом, выражение концентрации водородного иона и рН изменится несущественно.
[H+]=Кдисс 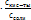
[OH-]=Кдисс NH4OH*Ссоли
рОН= - lg[OH]
рН=14-рОН
44. Равновесие растворения и диссоциации малорастворимого электролита. Произведение растворимости. Связь ПР и растворимости на примере…
KtnAm(k)↔ KtnAm↔ nKtm++mAn-
насыщ.р-р насыщ.р-р
В водных растворах все малорастворимые электролиты не ассоциированы. Другими словами, средняя стадия написанного равновесия отсутствует.
KtnAm(k) ↔ n Ktm++mAn-
Соответствующая константа равновесия с учетом того, что концентрация индивидульаного кристаллического в-ва равна единице, принимает вид:
Kравн=[Ktm+]n∙[An-]m= произведение растворимости (ПР)
Таким образом, произведение растворимости (ПР) есть константа равновесия растворения и диссоциации малорастворимого электролита. Оно численно равно произведению концентраций(активностей) ионов в степенях стехиометрических коэффициентов в насыщенном водном растворе данного малорастворимого электролита.
[Ktm+]= nP; [An-]=mP
ПР = [Ktm+]n∙[An-]m = (nP)n(mP)m=nnmmPn+m
Если ПК>ПР – выпадет осадок, ПК<ПР -осадок растворится, ПК=ПР -установится равновесие.
ПК=[Ktm+]n∙[An-]m. ПК – произведение концентраций.
48. Полный (необратимый) гидролиз. Приведите 2 примера. Совместный гидролиз двух солей с образованием а)гидроксида металла (+3), б) основного карбоната металла (+2).
|
из
5.00
|
Обсуждение в статье: Типичные окислители в ОВР. Каковы продукты их восстановления? Классификация ОВР. Приведите примеры. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

