 |
Главная |
Примеры решения заданий
|
из
5.00
|
Пример 1. Гальванопара алюминий-железо в воде (среда нейтральная). В воде растворен кислород.
Al / H2O, O2 / Fe
1. Потенциалы металлов:
 = -1,88 B;
= -1,88 B;  = - 0,46B.
= - 0,46B.
2. Потенциалы возможных окислителей (деполяризаторов):
 = – 0,41 В;
= – 0,41 В;  = + 0,814 B.
= + 0,814 B.
Al – анод (А); Fe – катод (К)$ окислитель - О2.
3. Электронно-ионные уравнения полуреакций анодного и катодного процессов:
 A (Al): 4 Al - 3ē + 3Н2О = Al(OH)3+ 3Н+ - процесс окисления;
A (Al): 4 Al - 3ē + 3Н2О = Al(OH)3+ 3Н+ - процесс окисления;
 K (Fe): 3 О2 + 4ē + 2Н2 О = 4ОН– - процесс восстановления
K (Fe): 3 О2 + 4ē + 2Н2 О = 4ОН– - процесс восстановления
4. Суммарные ионное и молекулярное уравнения:
 4 Al + 12 Н2О + 3 О2 + 6 Н2О = 4 Al(OH)3+ 12 Н+ + 12 ОН–
4 Al + 12 Н2О + 3 О2 + 6 Н2О = 4 Al(OH)3+ 12 Н+ + 12 ОН–
12 Н2О
4 Al + 3 О 2 + 6 Н2О = 4 Al(OH)3.
5. Направление движения электронов от участка с меньшим потенциалом к участку с большим потенциалом (от анода к катоду):
 ē
ē
 А – Al │ Fe К + ē
А – Al │ Fe К + ē
O2, H2O .
Пример 2. Определить процессы, протекающие при коррозии луженого железа (в растворе HCl), если нарушена сплошность покрытия:
Fe / Н2О, НCl / Sn.
1. Потенциалы металлов:
 = - 0,44 B;
= - 0,44 B;  = - 0,136 B.
= - 0,136 B.
2. Потенциалы возможных окислителей (деполяризаторов):
 = – 0,00 В
= – 0,00 В
Fe – анод (А); Sn – катод (К); окислитель - H+.
3. Электронно-ионные уравнения полуреакций анодного и катодного процессов:
 A (Fe): 1 Fe - 2ē = Fe 2+ –процесс окисления
A (Fe): 1 Fe - 2ē = Fe 2+ –процесс окисления
K (Sn): 1 2Н+ + 2ē = Н2 – процесс восстановления.

4. Суммарные ионное и молекулярное уравнения:
Fe + 2Н+ = Fe2+ + Н2
Fe + 2НCl = FeCl2 + Н2.
5. Направление движения электронов от участка с меньшим потенциалом к участку с большим потенциалом (от анода к катоду):
 ē
ē
 А– Fe │ Sn К+ ē
А– Fe │ Sn К+ ē
Н2О, НCl .
Пример 3. Рассмотреть коррозию детали из железа и алюминия в щелочной среде (КОН), если растворенный кислород отсутствует.
Al / КОН, H2O / Fe
1. Потенциалы металлов:
 = -2,36 B;
= -2,36 B; 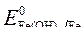 = - 0,874 B.
= - 0,874 B.
2. Потенциал окислителя (деполяризатора):
 = - 0,827 B.
= - 0,827 B.
Al – анод (А); Fe – катод (К); окислитель - Н2О.
 3. Электронно-ионные уравнения полуреакций анодного и катодного процессов:
3. Электронно-ионные уравнения полуреакций анодного и катодного процессов:
A (Al): 2 Al - 3ē + 4OH – = AlO2– + 2H2O – процесс окисления
 K (Fe): 3 2 H2O + 2ē = 2 OH – + H2 – процесс восстановления.
K (Fe): 3 2 H2O + 2ē = 2 OH – + H2 – процесс восстановления.
4. Суммарные ионное и молекулярное уравнения:
2 Al + 8 OH– + 6 H2O = 2 AlO2– + 4 H2O + 6 OH– + 3 H2
2 Al + 2 OH – + 2H2O = 2 AlO2– + 3 H2
2 Al + 2 КOH + 2H2O = 2 КAlO2 + 3 H2.
5. Направление движения электронов от участка с меньшим потенциалом к участку с большим потенциалом (от анода к катоду):
 ē
ē
 А – Al │ Fe К + ē
А – Al │ Fe К + ē
H2O, KOH .
Задания для самостоятельной подготовки
Рассмотрите коррозию гальванопары, используя потенциалы (табл. П. 7): укажите анод и катод, напишите электронно-ионные уравнения полуреакций анодного и катодного процессов, суммарные ионное и молекулярное уравнения окислительно-восстановительной реакции, протекающей при гальванокоррозии, укажите направление перемещения электронов в системе.
| Коррозионная среда | ||
| H2O + O2 | NaOH + H2O | HCl р-р |
| 1. Fe / Zn | 11. Fe / Cu | 21. Pb / Zn |
| 2. Fe / Ni | 12. Zn / Sn | 22. Al / Cu |
| 3. Pb / Fe | 13. Cd / Cr | 23. Al / Ni |
| 4. Cu / Zn | 14. Al / Cu | 24. Sn / Cu |
| 5. Zn / Fe | 15. Fe / Cr | 25. Co / Al |
| 6. Zn / Al | 16. Al / Fe | 26. Cr / Ni |
| 7. Cr / Cu | 17. Pb / Cr | 27. Al / Fe |
| 8. Cu / Al | 18. Cr / Zn | 28. Fe / Mg |
| 9. Zn / Sn | 19. Mg / Cd | 29. Cr / Bi |
| 10. Co / Mg | 20. Zn / Fe | 30. Pb / Al |
Э лектролиз растворов
Электролиз – совокупность процессов, протекающих при пропускании электрического тока через раствор или расплав электролита. В случае пропускания электрического тока через водный раствор электролита процесс осложняется возможностью участия в процессе электролиза воды. При электролизе происходит превращение электрической энергии в химическую.
Ячейка для электролиза, называемая электролизером, состоит из емкости, наполненной раствором электролита и двух электродов. Катод – электрод, на котором идет реакция восстановления, у электролизера подключен к отрицательному полюсу источника тока. Анод – электрод, на котором протекает реакция окисления, подключен к положительному полюсу источника тока.
Электроды, используемые в ходе электролиза, можно разделить на активные (расходуемые) и инертные (нерасходуемые). Активным называется анод, материал которого может окисляться в ходе электролиза. Инертным называется анод, материал которого не окисляется в ходе электролиза. В качестве материалов для инертных анодов чаще всего применяют графит, уголь, платину.
Катодные процессы
На катоде могут происходить следующие процессы восстановления:
· восстановление молекул воды (в нейтральной или щелочной среде):
2H2O + 2 ē = H2 + 2OH 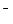 ,
, 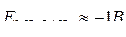
· ионов водорода (в кислой среде):
2H+ + 2 ē = H2
· восстановление ионов металлов:
Меn+ + n ē = Ме
Последовательность, в которой происходит восстановление ионов металлов на катоде из растворов, определяется рядом стандартных электродных потенциалов. Чем левее металл в ряду стандартных потенциалов, тем труднее его ион восстанавливается при электролизе. При этом возможны три случая:
· катионы металлов, имеющих стандартный потенциал больший, чем у водорода (от Н+ до Au3+), при электролизе практически полностью восстанавливаются на катоде, выделения водорода не происходит;
· катионы металлов, имеющих малую величину (менее –1 В) стандартного потенциала (от начала ряда до Mn2+ включительно), не восстанавливаются на катоде, а вместо них восстанавливается водород из молекул воды;
· катионы металлов, имеющих стандартный электродный потенциал меньший, чем у водорода, но больший, чем у алюминия (от Mn2+ до Н+), при электролизе на катоде восстанавливаются одновременно с молекулами воды.
Анодные процессы
На аноде также может происходить несколько процессов:
· окисление и растворение металла анода при электролизе с активным анодом:
Me – ē = Men+
· окисление молекул воды (в нейтральной или кислой среде):
2H2O – 4 ē = O2 + 4H+, 
· окисление гидроксид-ионов (в щелочной среде):
4OH– – 4 ē = O2 + 2H2O
· окисление анионов солей (NO2–, S2–, SO32– и др.).
Если в растворе присутствуют анионы, содержащие элементы в высшей степени окисления или анионы, потенциал которых больше +1,8 В (например, F–), то на аноде окисляются молекулы воды.
Окислению на аноде могут подвергаться только анионы, потенциал которых меньше +1,8 В:
2I– – 2 ē = I2 , Е 0 = – 0,54 В
SO32– – 2 ē + 2 OH– = SO42– + H2O , Е 0 = – 0,93 В
Законы фарадея
Законы Фарадея определяют зависимость между количеством прошедшего электричества и количеством вещества, подвергшегося химическому превращению на электроде.
1. Масса образующегося или растворяющегося при электролизе вещества пропорциональна количеству прошедшего через раствор электричества.
2. При электролизе различных химических соединений равные количества электричества приводят к электрохимическому превращению эквивалентных количеств веществ.
При проведении электрохимических расчетов используют формулу
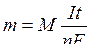 ,
,
где m – масса вещества, выделившегося на электроде, г;
I – сила тока, А;
t – время, с;
n – число электронов, участвующих в процессе;
F – постоянная Фарадея, 96485 Кл/моль (округленно 96500Кл/моль).
Определение объема выделяющихся газообразных продуктов при нормальных условиях можно рассчитать в соответствии с уравнением
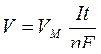 ,
,
где V – объем выделяющегося газа, л;
VM – молярный объем газа (при нормальных условиях 22,4 л/моль.)
|
из
5.00
|
Обсуждение в статье: Примеры решения заданий |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

