 |
Главная |
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
|
из
5.00
|
Материалы и методы исследования.
Температуры плавления определяли на приборе ПТП.
Спектры 1Н ЯМР получены на приборе Bruker AVANCE III HD (400 МГц). Внутренний стандарт – Me4Si. Приведены химические сдвиги в м.д. (δ-шкала) (Институт живых систем Северо-Кавказского федерального университета, г. Ставрополь).
Для проведения синтеза был использован микроволновой реактор «Monowave 200» (производитель AntonPaar, Австрия), частота магнетрона 2455 МГц, виалы с максимальным объемом заполнения 10 и 30 мл.
Система ВЭЖХ в сочетании с тандемной масс-спектрометрией «Ultimate 3000/ TSQ Quantum Access MAX (Thermo Scientific)».
ИК-спектры образцов исследованы на Фурье-спектрометре Perkin-Elmer Spectrum Two, оснащенном призмой НПВО, в диапазоне 4000–400 см-1.
Элементный анализ на содержание углерода, азота и водорода проводили с использованием анализатора EuroVector EuroEA 3000 при сжигании навески образца в токе кислорода с последующим хроматографированием газообразных продуктов сгорания в токе гелия. Точность определения содержания элементов составила 0,1 %.
Спектры возбуждения и люминесценции были записаны на спектрофлюориметре Horiba «FluoroMax-4».
ТСХ проводили на пластинках Sorbfil-АФВ-УФ («Сорбполимер», Россия). Вещества обнаруживали УФ (254 нм) и 1% раствором нингидрина в изопропиловом спирте с последующим нагреванием до 200 oС. Использовали системы растворителей: хлороформ – изопропиловый спирт, 15:1; изопропиловый спирт – бензол, 10:1.
Использованные реактивы и реагенты.
1,2-Фенилендиамин – М= 108,14г/моль, бесцветные кристаллы, Тпл.= 103,8 °С, Ткип.= 257 °С.
Бензол – М= 78,11 г/моль, бесцветная жидкость с характерным запахом, Тпл= 5,53 оС, Ткип= 80,1 оС , d420= 0,879 г/мл.
Изопропиловый спирт – M= 60,09 г/моль, бесцветная прозрачная жидкость с характерным запахом, Тпл= -89,5 °C, Ткип= 82,4 оС, d420 = 0,785 г/мл.
Бензальдегид – М= 106,12 г/моль, бесцветная жидкость с характерным запахом, Тпл= -26 °C, Ткип= 178,1 оС, d420= 1,0415 г/мл.
4-Метоксибензальдегид – М= 136,15 г/моль, бесцветная маслянистая жидкость с пряным запахом, Тпл= 1 °C, Ткип= 248–249 оС, d420=1,119 г/мл.
4-Метилбензальдегид – М= 120,2 г/моль, бесцветная жидкость с характерным запахом, Тпл= -6 °C, Ткип= 204 оС, d420= 1,0194 г/мл.
4-Диметиламинобензальдегид – М= 149,19 г/моль, светло-желтый кристаллический порошок, Тпл= 74 °C, Ткип= 176–177 оС, d420= 1,072 г/мл.
2,4-Дихлорбензальдегид – М= 175,01 г/моль, белый кристаллический порошок, Тпл= 69–73 °C, Ткип= 233 оС, d420= 1,4 г/мл.
Ацетонитрил – М= 41,05 г/моль, бесцветная жидкость со слабым эфирным запахом, Тпл= -44 °C, Ткип= 81,6 оС, d420= 0,7875 г/мл.
Хлорид цинка – М= 136,29 г/моль, белые гигроскопичные кристаллы, Тпл= 318 °C, Ткип= 732 оС, d420= 2,91 г/мл.
Салициловый альдегид – М= 122,12 г/моль, бесцветная жидкость с резким и навязчивым фенольным запахом, Тпл= -7 °C, Ткип= 196–197 оС, d420= 1,167 г/мл.
2-Гидроксиацетофенон – М= 136,15 г/моль, бесцветная жидкость, Тпл= 3–6 °C, Ткип= 213 оС, d420= 1,131 г/мл.
Ацетоуксусный эфир – М= 130,14 г/моль, бесцветная жидкость, Тпл= 45 оС , Ткип= 180,8 оС , d420= 1,0284 г/мл.
Этиловый спирт – М= 46,07 г/моль, бесцветная жидкость с характерным запахом, Тпл= -114,3 оС , Ткип= 78,4 оС , d420= 0,7893 г/мл.
Тиомочевина – М= 76,12 г/моль, белые кристаллы, Tпл = 182 °C.
Гидразин гидрат – М= 50,06 г/моль, бесцветная жидкость, Тпл= 51,7 °C, Ткип = 120 °C, d420 = 1,032 г/мл.
Пероксид водорода – М= 34,01 г/моль, бесцветная жидкость, Tпл= -0,432 °С, Tкип= 150,2 °С, d420 = 1,4 г/мл.
Соляная кислота – М= 36,46 г/моль, бесцветная, прозрачная жидкость, Тпл= -30 оС, Ткип= 48 оС, d420= 1,19 г/мл.
Гидроксид натрия – М= 39,997 г/моль, белое твердое вещество, Тпл= 323 оС, Ткип= 1403 оС , d420= 2,13 г/мл.
Методики синтезов.
2.3.1. Синтез 2-меркаптобензимидазола.

54 г (0,5 моль) 1,2-фенилендиамина сплавляли с 38 г (0,5 моль) тиомочевины при постоянном перемешивании и нагревании на песчаной бане в течение 1 часа при температуре 150–160 оС. По окончанию реакции реакционную смесь охладили, затем растворили в 150 мл 20%-ного раствора гидроксида натрия, после чего нагрели до кипения и добавили активированный уголь и кипятили еще в течение 10 мин. Горячий раствор отфильтровали, фильтрат охладили до комнатной температуры и нейтрализовали концентрированной соляной кислотой до pH= 5. Выпавший белый осадок 2-меркаптобензимидазола отфильтровали, промыли холодной водой и высушили на воздухе. Выход: 40,39 г (54%), Тпл= 301–305 °С [7].
2.3.2. Синтез бензимидазол-2-сульфокислоты.
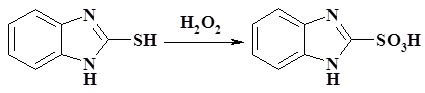
В трехгорлой литровой колбе, снабженной мешалкой, термометром и капельной воронкой (не допускать герметичности прибора), растворили 40,39 г (0,3 моль) 2-меркаптобензимидазола в растворе 23 г (0,6 моль) гидроксида натрия в 120 мл воды. Полученную реакционную смесь охладили до 20 °С и добавляли по каплям при энергичном перемешивании и охлаждении ледяной водой 80 мл 60%-ного пероксида водорода с такой скоростью, чтобы температура реакционной смеси не поднималась выше 37–40 °С. Первые 30–40 мл пероксида водорода необходимо добавлять особенно осторожно, так как вследствие сильного разогревания возможен выброс реакционной массы. По окончанию прибавления раствора пероксида водорода смесь перемешивали при комнатной температуре еще 4 часа, а затем оставили на ночь. На следующий день раствор подкислили концентрированной соляной кислотой до рН= 1–2. Белоснежный осадок бензимидазол-2-сульфокислоты отфильтровали из охлажденного раствора, тщательно промыли холодной водой и высушили на воздухе. Выход: 52,36 г (95%), Тпл= 365–368 °С [7].
2.3.3. Синтез 2-гидразинобензимидазола.

В плоскодонную колбу добавили 52,36 г (0,26 моль) бензимидазол-2-сульфокислоты, 70 мл гидразин гидрата и 100 мл воды и нагревали с обратным холодильником в течение 1 часа при интенсивном перемешивании, процесс контролировали методом ТСХ. По окончанию реакции реакционную смесь охладили до комнатной температуры, выпавший осадок 2-гидразино-бензимидазола отфильтровали, промыли холодной водой и высушили на воздухе. Выход: 29,46 г (75%), Тпл= 127–129 °С.
2.3.4. Синтез 1-этил-2-гидразинобензимидазола.
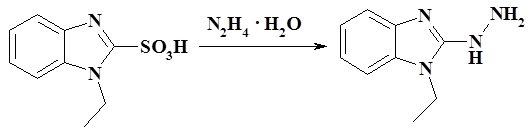
В плоскодонную колбу добавили 31 г (0,14 моль) 1-этилбензимидазол-2-сульфокислоты, 70 мл гидразин гидрата и 100 мл воды и нагревали с обратным холодильником в течение 1 часа при интенсивном перемешивании, процесс контролировали методом ТСХ. По окончанию реакции реакционную смесь охладили до комнатной температуры, выпавший осадок 1-этил-2-гидразинобензимидазола отфильтровали, промыли холодной водой и высушили на воздухе. Выход: 19,65 г (81%), Тпл= 115–117 °С.
1Н ЯМР-спектр (DMSO-d6): 1,18 м.д. (т, 3Н, –СН3); 3,99 м.д. (к, 2Н, –СН2–); 6,88–7,32 м.д. (м, 4Н, Ar).
2.3.5. Синтез 1-(1 H -бензимидазол-2-ил)-4,5-дигидро-3,5-дифенилпира-зола.

1) Смесь 0,74 г (0,005 моль) 2-гидразинобензимидазола и 1,04 г (0,005 моль) 1,3-дифенилпропен-3-она растворили в 20 мл этилового спирта при нагревании с обратным холодильником в течение 1 часа при интенсивном перемешивании, процесс контролировали методом ТСХ. По окончанию реакции реакционную смесь охладили до комнатной температуры, выпавший осадок отфильтровали, перекристаллизовали из этилового спирта и высушили на воздухе. Выход: 0,48 г (28%). Тпл= 217–220 °С.
2) Смесь 0,74 г (0,005 моль) 2-гидразинобензимидазола и 1,04 г (0,005 моль) 1,3-дифенилпропен-3-она растворили в 5 мл этилового спирта. Синтез проводили в микроволновом реакторе «Monowave 200» при температуре 125 ºС и перемешивании в течение 1 часа. По окончанию реакции реакционную смесь охладили до комнатной температуры, выпавший осадок отфильтровали, перекристаллизовали из этилового спирта и высушили на воздухе. Выход: 1,25 г (74%), Тпл.= 221–222 °С. ESI+-MS m/z 339,20 [M+Н]+, вычислено для С22H19N4 339,41.
1Н ЯМР-спектр (DMSO-d6): 3,21 м.д. (м, 1Н, –СН2–); 4,01 м.д. (м, 1Н, –СН2–); 5,69 м.д. (с, 1Н, –CH–); 6,86–7,93 м.д. (м, 14Н, Ar); 11,78 м.д. (с, 1Н, –NH–).
2.3.6. Синтез 2-(1 H -бензимидазол-2-ил)-5-метил-1,2-дигидро-3 H -пира-зол-3-она.

1) В плоскодонной колбе растворили 1,5 г (0,01 моль) 2-гидразино-бензимидазола в 10 мл этилового спирта, затем добавили 1,2 мл (0,01 моль) ацетоуксусного эфира и нагревали с обратным холодильником в течение 30 мин с прибавлением 5 капель соляной кислоты при интенсивном перемешивании, процесс контролировали методом ТСХ. По окончанию реакции реакционную смесь охладили до комнатной температуры, выпавший осадок отфильтровали, промыли этиловым спиртом и высушили на воздухе. Выход: 1,63 г (76%), Тпл.= 217–218 °С. ESI+-MS m/z 215,10 [M+Н]+, вычислено для С11H11N4O 215,23.
2) В виале растворили 1,5 г (0,01 моль) 2-гидразинобензимидазола в 3 мл этилового спирта, затем добавили 1,2 мл (0,01 моль) ацетоуксусного эфира и 5 капель соляной кислоты. Синтез проводили в микроволновом реакторе «Monowave 200» при температуре 100 ºС и перемешивании в течение 30 мин. По окончанию реакции реакционную смесь охладили до комнатной температуры, выпавший осадок отфильтровали, промыли этиловым спиртом и высушили на воздухе. Выход: 1,53 г (71%), Тпл.= 219–220 °С. ESI+-MS m/z 215,14 [M+Н]+, вычислено для С11H11N4O 215,23.
1Н ЯМР-спектр (DMSO-d6): 2,19 м.д. (с, 3Н, –СН3); 5,24 м.д. (с, 1Н, –СН–); 7,10–7,59 м.д. (м, 4Н, Ar).
2.3.7. Синтез (1 Z )-1-(2-гидроксифенил)этанон-1 H -бензимидазол-2-илгидразона.

В плоскодонной колбе растворили 1,48 г (0,01 моль) 2-гидразино-бензимидазола в 10 мл изопропилового спирта, затем добавили 1,2 мл (0,01 моль) 2-гидроксиацетофенона и нагревали с обратным холодильником в течение 1 часа при интенсивном перемешивании, процесс контролировали методом ТСХ. По окончанию реакции реакционную смесь охладили до комнатной температуры, выпавший осадок отфильтровали, промыли холодным изопропиловым спиртом и высушили на воздухе. Выход: 1,22 г (46%), Тпл.= 175–177 °С. ESI+-MS m/z 267,14 [M+Н]+, вычислено для С15H15N4O 267,12.
2.3.8. Синтез (1 Z )-1-(2-гидроксифенил)этанон-(1-этил-1 H -бензимида-зол-2-ил)гидразона.

В плоскодонной колбе растворили 1,76 г (0,01 моль) 1-этил-2-гидразино-бензимидазола в 10 мл изопропилового спирта, затем добавили 1,2 мл (0,01 моль) 2-гидроксиацетофенона и нагревали с обратным холодильником в течение 1 часа при интенсивном перемешивании, процесс контролировали методом ТСХ. По окончанию реакции реакционную смесь охладили до комнатной температуры, выпавший осадок отфильтровали, промыли холодным изопропиловым спиртом и высушили на воздухе. Выход: 1,38 г (47%), Тпл.= 132–135 °С. ESI+-MS m/z 295,21 [M+Н]+, вычислено для С17H19N4O 295,36.
2.3.9. Синтез 2-гидроксибензальдегид-1 H -бензимидазол-2-илгидразона.
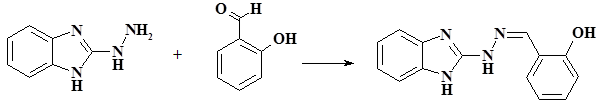
В плоскодонной колбе растворили 1,48 г (0,01 моль) 2-гидразино-бензимидазола в 10 мл изопропилового спирта, затем добавили 1 мл (0,01 моль) салицилового альдегида и нагревали с обратным холодильником в течение 1 часа при интенсивном перемешивании, процесс контролировали методом ТСХ. По окончанию реакции реакционную смесь охладили до комнатной температуры, выпавший осадок отфильтровали, промыли холодным изопропиловым спиртом и высушили на воздухе. Выход: 2,2 г (87%), Тпл.= 257–259 °С. ESI+-MS m/z 253,16 [M+Н]+, вычислено для С14H13N4O 253,28.
2.3.10. Синтез 2-гидроксибензальдегид(1-этил-1 H -бензимидазол-2-ил)гидразона.

В плоскодонной колбе растворили 1,76 г (0,01 моль) 1-этил-2-гидразинобензимидазола в 10 мл изопропилового спирта, затем добавили 1 мл (0,01 моль) салицилового альдегида и нагревали с обратным холодильником в течение 1 часа при интенсивном перемешивании, процесс контролировали методом ТСХ. По окончанию реакции реакционную смесь охладили до комнатной температуры, выпавший осадок отфильтровали, промыли холодным изопропиловым спиртом и высушили на воздухе. Выход: 1,53 г (55%), Тпл.= 168–170 °С. ESI+-MS m/z 281,18 [M+Н]+, вычислено для С16H17N4O 281,33.
2.3.11. Синтез бензальдегид-1 H -бензимидазол-2-илгидразона.
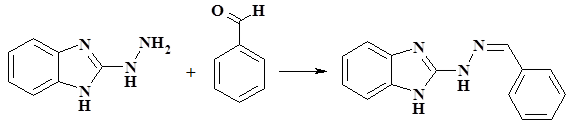
В плоскодонной колбе растворили 0,74 г (0,005 моль) 2-гидразино-бензимидазола в 10 мл изопропилового спирта, затем добавили 0,5 мл (0,005 моль) бензальдегида и нагревали с обратным холодильником в течение 1 часа при интенсивном перемешивании, процесс контролировали методом ТСХ. По окончанию реакции реакционную смесь охладили до комнатной температуры, выпавший осадок отфильтровали, промыли холодным изопропиловым спиртом и высушили на воздухе. Выход: 1,88 г (91%), Тпл.= 214–215 °С. ИК-спектр (  , см-1): 3500 (N-Н, гидразон), 2800 (N-Н, имидазол), 1637 (C=N). ESI+-MS m/z 237,14 [M+Н]+, вычислено для С14H13N4 237,28.
, см-1): 3500 (N-Н, гидразон), 2800 (N-Н, имидазол), 1637 (C=N). ESI+-MS m/z 237,14 [M+Н]+, вычислено для С14H13N4 237,28.
2.3.12. Синтез 4-метоксибензальдегид-1 H -бензимидазол-2-илгидразона.

В плоскодонной колбе растворили 0,74 г (0,005 моль) 2-гидразино-бензимидазола в 10 мл изопропилового спирта, затем добавили 0,6 мл (0,005 моль) 4-метоксибензальдегида и нагревали с обратным холодильником в течение 1 часа при интенсивном перемешивании, процесс контролировали методом ТСХ. По окончанию реакции реакционную смесь охладили до комнатной температуры, выпавший осадок отфильтровали, промыли холодным изопропиловым спиртом и высушили на воздухе. Выход: 1,18 г (89%), Тпл.= 226–228 °С. ESI+-MS m/z 267,31 [M+Н]+, вычислено для С15H15N4O 267,31.
2.3.13. Синтез 4-диметиламинобензальдегид-1 H -бензимидазол-2-илгидразона.

В плоскодонной колбе растворили 0,74 г (0,005 моль) 2-гидразино-бензимидазола в 10 мл изопропилового спирта, затем добавили 0,75 г (0,005 моль) 4-диметиламинобензальдегида и нагревали с обратным холодильником в течение 1 часа при интенсивном перемешивании, процесс контролировали методом ТСХ. По окончанию реакции реакционную смесь охладили до комнатной температуры, выпавший осадок отфильтровали, промыли холодным изопропиловым спиртом и высушили на воздухе. Выход: 1,23 г (88%), Тпл.= 228–230 °С. ESI+-MS m/z 280,24 [M+Н]+, вычислено для С16H18N5 280,35.
2.3.14. Синтез 4-метилбензальдегид-1 H -бензимидазол-2-илгидразона.

В плоскодонной колбе растворили 0,74 г (0,005 моль) 2-гидразино-бензимидазола в 10 мл изопропилового спирта, затем добавили 0,6 мл (0,005 моль) 4-метилбензальдегида и нагревали с обратным холодильником в течение 1 часа при интенсивном перемешивании, процесс контролировали методом ТСХ. По окончанию реакции реакционную смесь охладили до комнатной температуры, выпавший осадок отфильтровали, промыли холодным изопропиловым спиртом и высушили на воздухе. Выход: 1,1 г (88%), Тпл.= 236–237 °С. ESI+-MS m/z 251,21 [M+Н]+, вычислено для С15H15N4 251,31.
2.3.15. Синтез 2,4-дихлорбензальдегид-1 H -бензимидазол-2-илгидразона.

В плоскодонной колбе растворили 0,74 г (0,005 моль) 2-гидразино-бензимидазола в 10 мл изопропилового спирта, затем добавили 0,88 г (0,005 моль) 4-метилбензальдегида и нагревали с обратным холодильником в течение 1 часа при интенсивном перемешивании, процесс контролировали методом ТСХ. По окончанию реакции реакционную смесь охладили до комнатной температуры, выпавший осадок отфильтровали, промыли холодным изопропиловым спиртом и высушили на воздухе. Выход: 1,45 г (95%), Тпл.= 237–238 °С. ESI+-MS m/z 305,07 [M+Н]+, вычислено для С14H11Cl2N4 305,04.
2.3.16. Синтез 1-пентил-1 H -бензимидазол-2-карбальдегид-1 H -бензимидазол-2-илгидразона.

В плоскодонной колбе растворили 0,74 г (0,005 моль) 2-гидразино-бензимидазола в 10 мл изопропилового спирта, затем добавили 1,08 г (0,005 моль) 1-пентил-1H-бензимидазол-2-карбальдегида и нагревали с обратным холодильником в течение 1 часа при интенсивном перемешивании, процесс контролировали методом ТСХ. По окончанию реакции реакционную смесь охладили до комнатной температуры, выпавший осадок отфильтровали, промыли холодным изопропиловым спиртом и высушили на воздухе. Выход: 1,4 г (81%), Тпл.= 218–219 °С. ESI+-MS m/z 347,25 [M+Н]+, вычислено для С20H23N6 347,44.
2.3.17. Синтез комплекса цинка с бензальдегид-1H-бензимидазол-2-илгидразоном.

В плоскодонной колбе растворили 0,5 г (0,002 моль) бензальдегид-1H-бензимидазол-2-илгидразон в 25 мл ацетонитрила при нагревании и интенсивном перемешивании, затем добавили 0,272 г (0,002 моль) хлорида цинка и в течение 1 часа нагревали при интенсивном перемешивании. По окончанию реакции реакционную смесь охладили до комнатной температуры, выпавший осадок отфильтровали, промыли этиловым спиртом и высушили на воздухе. Выход: 0,285 г (36%).
ИК-спектр ( 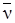 , см-1): 3200 (N-Н), 1625 (C=N).
, см-1): 3200 (N-Н), 1625 (C=N).
По данным элементного анализа состав комплекса отвечает формуле ZnLCl2. Найдено, %: C – 44,56, H – 3,91, N – 15,05. Для C14H12N4ZnCl2 вычислено, %: C – 45,09, H – 3,22, N – 15,03.
2.3.18. Синтез комплекса цинка с 4-метоксибензальдегид-1H-бензимидазол-2-илгидразоном.

В плоскодонной колбе растворили 0,5 г (0,0019 моль) 4-метокси-бензальдегид-1H-бензимидазол-2-илгидразон в 25 мл ацетонитрила при нагревании и интенсивном перемешивании, затем добавили 0,258 г (0,0019 моль) хлорида цинка и в течение 1 часа нагревали при интенсивном перемешивании. По окончанию реакции реакционную смесь охладили до комнатной температуры, выпавший осадок отфильтровали, промыли этиловым спиртом и высушили на воздухе. Выход: 0,625 г (83%).
По данным элементного анализа состав комплекса отвечает формуле ZnLCl2. Найдено, %: C – 44,41, H – 4,12, N – 13,77. Для C15H14N4OZnCl2 вычислено, %: C – 44,75, H – 3,47, N –.13,91
2.3.19. Синтез комплекса цинка с 4-диметиламинобензальдегид-1H-бензимидазол-2-илгидразоном.
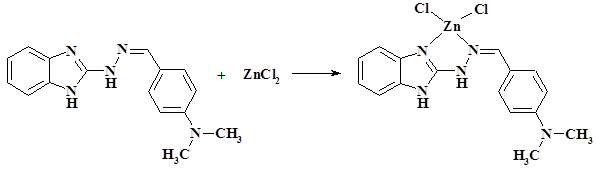
В плоскодонной колбе растворили 0,470 г (0,0017 моль) 4-диметиламинобензальдегид-1H-бензимидазол-2-илгидразон в 25 мл ацетонитрила при нагревании и интенсивном перемешивании, затем добавили 0,231 г (0,0017 моль) хлорида цинка и в течение 1 часа нагревали при интенсивном перемешивании. По окончанию реакции реакционную смесь охладили до комнатной температуры, выпавший осадок отфильтровали, промыли этиловым спиртом и высушили на воздухе. Выход: 0,570 г (82%).
По данным элементного анализа состав комплекса отвечает формуле ZnLCl2. Найдено, %: C – 46,21, H – 4,38, N – 16,72. Для C16H17N5ZnCl2 вычислено, %: C – 46,19, H – 4,09, N – 16,84.
2.3.20. Синтез комплекса цинка с 4-метилбензальдегид-1H-бензимидазол-2-илгидразоном.

В плоскодонной колбе растворили 0,485 г (0,0019 моль) 4-метилбензальдегид-1H-бензимидазол-2-илгидразон в 25 мл ацетонитрила при нагревании и интенсивном перемешивании, затем добавили 0,258 г (0,0019 моль) хлорида цинка и в течение 1 часа нагревали при интенсивном перемешивании. По окончанию реакции реакционную смесь охладили до комнатной температуры, выпавший осадок отфильтровали, промыли этиловым спиртом и высушили на воздухе. Выход: 0,575 г (77%).
По данным элементного анализа состав комплекса отвечает формуле ZnLCl2. Найдено, %: C – 46,51, H – 4,34, N – 14,20. Для C15H14N4ZnCl2 вычислено, %: C – 46,56, H – 3,62, N – 14,48.
|
из
5.00
|
Обсуждение в статье: МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

