 |
Главная |
Механизм роста и кинетика окисления
|
из
5.00
|
Процесс окисления кремния определяется:
– во-первых, химическими реакциями, которые формально можно представить как
Si + О2 → SiО2 (3.1 )
Si + 2Н2О → SiО2 + 2Н2 (3.2 )
– во-вторых, процессом диффузии окислителя через оксид к границе раздела фаз Si-SiO2, где и происходит в основном реакция окисления кремния. На рис. 3.1 показана кремниевая подложка, покрытая слоем оксида, который находится в контакте с газовой фазой. Молекулы окислителя диффундируют из объема газовой фазы к границе раздела газ-SiО2 и адсорбируются поверхностью оксида. На рис. 3.l F1 – поток окислителя во внешней среде; F2поток окислителя, диффундирующего через образовавшуюся пленку SiО2 по направлению к кремнию. Собственно, процессу взаимодействия кремния и окислителя можно сопоставить поток F3. В условиях равновесия все потоки равны F1= F2 = F3.
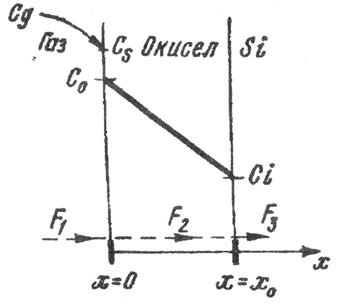
Рис .3.1. Схема для описания процесса окисления кремния
В дальнейшем мы будем придерживаться модели, предложенной в [1]. Модель применима для температурного диапазона 700–1300 °С, парциальных давлений окиcлитeля 0,2–1,0 атм. и толщин оксидных пленок 30–2000 нм в атмосфере кислорода и (или) паров воды. Принятая модель предполагает отсутствие изменения количества частиц окислителя на границе газ-SiО2. это значит, что через оксид диффундируют молекулы. Хотя на самом деле вопрос о природе частиц, диффундирующих через SiО2 к границе Si-SiО2 до конца не решен. Помимо предполагаемых схемой молекул О2 и Н2О могут быть О2– и ОН– ионы.
Если количество частиц окислителя в газовой фазе равно количеству частиц окислителя, диффундирующего через оксид, то имеет место линейная зависимость между потоком F1 и разностью концентраций окислителя в объеме газовой фазы Cg и в приповерхностном слое оксида С s
F1 = hg (Cg– Cs) (3.3)
где hg – коэффициент массопереноса в газовой фазе; Cg = ρg/kT; Cs = ρs/kT; ρs и ρg – парциальные давления окислителя в газовой фазе вблизи поверхности оксида и в объеме газовой фазы.
При принятых допущениях справедлив закон Генри, который позволяет связать равновесную концентрацию молекул окислителя в оксиде и газовой фазе
С0= H·ρs , Cv = H·ρg, (3.4)
В уравнениях (3.4) Н – постоянная, С0 и Cv – концентрации окислителя на границах газ–SiО2 и SiО2-Si, соответственно. Отметим, что при 1000 оС растворимость О2 в SiО2 составляет 5,2·1016 см–3, а для Н2О – 3,0·1019 см–3.
Объединение уравнений (3.3) и (3.4) дает:
F1 = h (Cv – С0) , (3.5)
где h = hg/НkT – коэффициент массопереноса в газовой фазе.
Поток диффундирующих частиц окислителя F2 описывается законом Фика
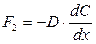 (3.6)
(3.6)
где D – коэффициент диффузии, dC/dx – градиент концентрации частиц окислителя в оксиде. Для установившегося процесса
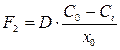 (3.7)
(3.7)
Скорость реакции окисления (или поток F3) пропорциональна концентрации взаимодействующих частиц, Поскольку в объеме твердого тела концентрация Si постоянна, то F3 пропорционален концентрации окислителя C i на границе Si-SiO2
F3= ksС i (3.8)
где ks – константа скорости химической реакции окисления кремния.
Скорость роста оксида (dx0/dt) определяется соотношением
dx0/dt = F3/N1 = kCi/N1 (3.9)
если N1 – число молекул окислителя, необходимое для образования единичного объема оксидного слоя. Поскольку оксид содержит 2,2·1022 молекул SiО2 в см–З и на создание одной молекулы SiО2 требуется одна молекула О2 и две молекулы Н2О, то N1 равно 2,2·1022 см–3 для окисления в сухом кислороде и удвоенному значению для окисления в парах воды. Совместное решение уравнений (3.5) – (3.8) при F1 = F2 = F3 дает выражение для C i
Ci = Cv /(1 +(ks /h) + (ks x0 /D)) , (3.10)
при подстановке которого в уравнение (3.9) получаем зависимость:
х02 + А х0 = В (t + τ) , (3.11)
где А = 2D(1/ks+ 1/h); В = 2DCv /N1; τ = d i2 + Ad i /B (τ – постоянная, которая отражает возможность наличия оксидной пленки на поверхности кремния толщиной d i к моменту начала термического окисления).
Пока пленка достаточно тонкая (t + τ) ˂˂ A2/ 4B, ее толщина, как видно из соотношения (3.11), увеличивается пропорционально времени, и процесс роста оксида лимитируется скоростью химической реакции. В этом случае зависимость x0(t) линейна
хо = (B/A)(t + τ) , (3.12)
В/А – линейная константа скорости окисления, определяемая выражением В/А = [ksh /(ks+h)]Cv /Ni.
Рост толстой пленки (t >> τ) лимитируется процессами диффузии. При этом имеется параболический участок зависимости x0(t)
х02 = Bt (3.13)
B – параболическая константа скорости окисления.
Константа В (или В/А) зависит от температуры Т, поскольку в нее входит константа скорости химической реакции ks и коэффициент диффузии D, которые экспоненциально зависят от Т.
Приведенная модель [1] для термического окисления кремния обеспечивает хорошее совпадение теоретических результатов с экспериментальными. Полученные из эксперимента зависимости толщины оксида от времени окисления кремния при атмосферном давлении и разных температурах приведены на рис. 3.2.
Из рисунка следует, что в интервале наиболее интересных для практики толщин оксида от 0,1 до нескольких микрон наблюдается близкая к параболической зависимость толщины оксида от времени окисления, причем она выполняется тем лучше, чем выше температура окисления.
Из рис. 3.2 следует также, что в парах воды окисление идет гораздо быстрее, а скорость роста слабее зависит от температуры, чем при окислении в сухом кислороде. Большая скорость окисления в парах воды обязана большей растворимости этого окислителя в SiО2.
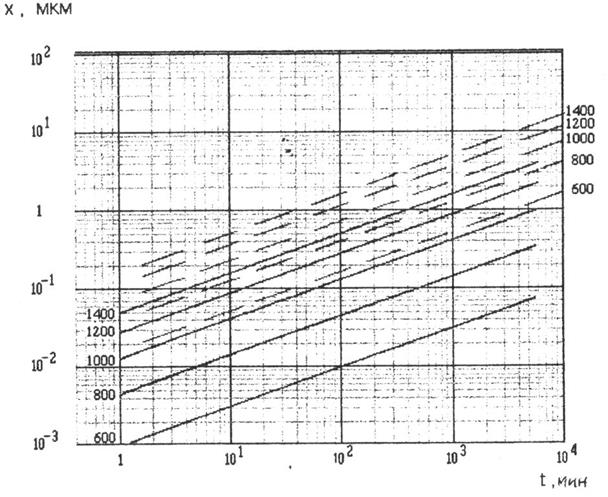
Рис. 3.2. Зависимость толщины оксида от времени окисления в сухом кислороде (сплошные линии) и парах воды (пунктир)
Для параболического участка зависимость толщины оксида от времени окислении при атмосферном давлении удовлетворительно описывается соотношениями:
при окислении в кислороде –
х02 = K0 ехр( – ∆E / kT) t = 12,9 ехр( – 1,24/ kT) t (3.14)
при окислении в парах воды –
х02 = К '0 ехр ( – ∆E '/ kT) t = 3,2 ехр( – 0,71 / kT) t. (3.15)
В выражениях (14), (15) t, мин – время окисления; х0, мкм – толщина оксидной пленки; k = 8,62·10–5, эВ/К – постоянная Больцмана; Т, К – температура; ∆Е('), эВ – энергия активации, характеризующая наклон температурной зависимости константы B. При окислении в сухом кислороде ∆E по величине близка энергии активации коэффициента диффузии кислорода в кварцевом стекле, а при окислении в парах воды и во влажном кислороде ∆E ' соответствует аналогичной величине процесса диффузии воды в кварцевом стекле. Для процесса окисления во влажном кислороде возможно в ряде случаев использовать закономерности, полученные для окисления в парах воды, поскольку даже небольшое количество паров воды сильно увеличивает скорость окисления. При точных расчетах скорости окисления в атмосфере влажного кислорода необходимо учитывать парциальные давления паров воды и кислорода.
Линейная зависимость (см. рис.3.2) в более или менее явном виде имеется лишь при окислении в парах воды, особенно при температурах окисления ниже 1000 0С. Как отмечалось, линейная зависимость связана с формированием тонкой пленки SiО2, когда процесс роста оксида определяется в основном реакцией окисления, то есть зависит от скорости, с которой атомы кремния переходят в оксидную форму. На этот процесс влияет поверхностная концентрация атомов кремния, различная для плоскостей (111), (100), (110) и т.д. Например, константа скорости реакции окисления Si в сухом кислороде в 1,7 раз выше для поверхности (111), чем для (100) при соответствующих температурах.
Температурная зависимость линейного участка скорости роста оксида описывается почти не зависящей от состава атмосферы энергией активации ∆E: 1,96 и 2,0 эВ для процессов окисления во влажном и сухом кислороде соответственно. Эти величины отражают температурную зависимость ks и сравнимы с энергией разрыва связей Si-SiО2, равной 1,83 эВ.
В структурном отношении оксид, полученный термическим окислением кремния, аморфен и по своим свойствам аналогичен плавленому кварцу, причем имеет место высокая однородность свойств по толщине пленки. Исключением является слой оксида толщиной 10 – 20 нм на границе раздела Si-SiО2. Структура границы раздела Si-SiО2 и механизм окисления на атомном уровне достаточно сложны и до конца не ясны. Это усугубляется большой разницей между значениями плотности Si и SiО2 , поэтому рост оксидной пленки толщиной 1dSiO2 происходит за счет слоя Si толщиной 0,45dsi. В связи с этим движение границы Si-SiО2 вглубь кремния требует постоянного потока вакансий к границе раздела из объема кремния и перемещения избыточных межузельных атомов Sii в противоположном направлении вглубь кремния. Этот механизм качественно хорошо объясняет сопутствующие окислению диффузию, возникновение межфазного разряда в оксиде и др. Пересыщение объема кремния вблизи границы Si-SiО2 собственными межузельными атомами приводит к формированию на границе дефектов упаковки внедрения. Концентрация дефектов упаковки при окислении во влажном кислороде или парах воды больше, поскольку окисление идет с большей скоростью. Образование дефектов упаковки полностью подавляется, когда температура окисления ниже 950 °С, а также в. условиях, способствующих отводу избыточного кремния от границы SiО2-Si.
Дефектность фазовой границы SiО2-Si способствует собиранию вблизи нее примесей и дефектов, в результате чего возникает заряд на границе раздела фаз. Этот заряд индуцирует заряд противоположной полярности в приповерхностном слое кремния, расположенном вблизи границы. Величина последнего должна быть в большинстве случаев возможно меньше, так как она существенно влияет на характеристики полупроводниковых приборов, расположенных в объеме Si подложки. При окислении в сухом кислороде минимальная величина заряда достигается при температуре 1100–1200 °С. Эта температура зависит от толщины слоя Si и режимов охлаждения.
В ряде случаев при создании оксидных слоев необходимо считаться с тем, что на границе раздела возможны упругие напряжения, которые могут привести к короблению подложки, образованию трещин в пленке и дефектов в слоях под слоем SiO2. Основной причиной возникновения упругих напряжений является разница коэффициентов термического расширения между Si и SiО2. Наибольшие напряжения возникают, если рост осуществляется при Т ≤ 950 0С, в то время как окисление при 1000 0C и выше дает слои без упругих напряжений.
Изучение процессов окисления кремния при давлениях, отличающихся от атмосферного, показало, что скорость окисления является степенной функцией давления, причем показатель степени равен приблизительно 0,8 – для атмосферы кислорода и 1,6 – для паров воды. Перспективность окисления кремния при повышенном давлении окислителя состоит в дополнительном увеличении скорости роста при относительно низких температурах. Проведение процесса при низкой температуре сводит к минимуму продольную диффузию.
|
из
5.00
|
Обсуждение в статье: Механизм роста и кинетика окисления |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

