 |
Главная |
Тема 3. Основы химической кинетики
|
из
5.00
|
Основные понятия: скорость химической реакции, порядок реакции, период полупревращения, период полураспада, правило Вант-Гоффа, энергия активации, уравнение Аррениуса.
Основные расчётные формулы:
Скорость химической реакции определяет, как изменяется концентрация компонентов реакции с течением времени. Скорость химической реакции — величина всегда положительная, поэтому если она определяется по исходному веществу (концентрация которого убывает в процессе реакции), то полученное значение домножается на −1. Например для реакции

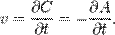
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ (закон действующих масс).
aA + bB ® сС + dD
u = k × Сa(A) × Сb(B)
где С – концентрация реагирующих веществ; коэффициент пропорциональности k не зависит от концентраций реагентов, а зависит только от температуры,  . Этот коэффициент называется константой скорости реакции.
. Этот коэффициент называется константой скорости реакции.
Обратите внимание, что в выражение для определения скорости реакции входят только концентрации жидких и газообразных веществ (площадь поверхности твёрдых веществ считается постоянной величиной и включается в константу скорости реакции).
Величина а – порядок реакции по реагенту А, величина b – порядок реакции по реагенту В. Сумма а и b – общий порядок реакции.
Кинетическое уравнение реакции нулевого порядка имеет следующий вид: u0 = k0
Скорость реакции нулевого порядка постоянна во времени и не зависит от концентраций реагирующих веществ. Нулевой порядок характерен, например, для гетерогенных реакций в том случае, если скорость диффузии реагентов к поверхности раздела фаз меньше скорости их химического превращения.
Первый порядок характерен для реакций распада пестицидов и инсектицидов, метаболизма лекарственных препаратов в организме, распада радиоактивных элементов.
Кинетическое уравнение реакции первого порядка: u1 = k1 × C = – dC / dt
Приведение уравнения к линейному виду даёт уравнение: ln C = ln C0 – k1 × t
где С – текущая концентрация вещества (через любой промежуток времени), С0 – исходная концентрация вещества (в начальный момент времени).
Время, за которое превращается исходное соединение, можно определить по формуле:
t = – ln(C/C0) / k = ln(C0/C) / k
Период полупревращения – время, за которое расходуется 50 % вещества или распадается 50 % радиоактивного элемента (в последнем случае это период полупаспада). В этом случае С = 0,5С0
Тогда для реакций первого порядка t = ln(C0/C) / k = ln(C0/0,5C0) / k = ln2 / k
При повышении температуры на каждые 10°C, скорость реакции возрастает в 2-4 раза (Правило Вант-Гоффа). При увеличении температуры от t1 до t2изменение скорости реакции можно рассчитать по формуле:
u2 / u1 = k2 / k1 = g(t2 – t1)/10
Правило Вант-Гоффа применимо только в узком интервале температур. Более точным является уравнение Аррениуса:
k = A × e–Ea / RT
где A – постоянная, зависящая от природы реагирующих веществ;
R – универсальная газовая постоянная [8,314 Дж/(моль • К)];
Ea – энергия активации, т.е. энергия, которой должны обладать сталкивающиеся молекулы, чтобы столкновение привело к химическому превращению.
Энергетическая диаграмма химической реакции.

| 
|
| Экзотермическая реакция | Эндотермическая реакция |
А – реагенты, В – активированный комплекс (переходное состояние), С – продукты.
Чем больше энергия активации Ea , тем сильнее возрастает скорость реакции при увеличении температуры.
Катализаторы – вещества, ускоряющие скорость химической реакции, при этом катализаторы в ходе реакции не расходуются. Катализаторы вступают во взаимодействие с одним из исходных веществ с образованием активированного комплекса (переходного состояния) с меньшей энергией активации. Таким образом, энергия активации в присутствии катализатора снижается, а скорость реакции увеличивается.
Зная константы скорости реакции при разных температурах, можно найти энергию активации реакции. Для того, чтобы избавиться от коэффициента А, два выражения для определения константы скорости реакции при двух температурах делят друг на друга.
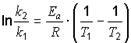 или
или 
Пример 6. Константа скорости реакции СО(г) + Cl2(г) = СОCl2(г) при 349 °С равна 3,81 ед., а при 395 ° С – 15,5 ед. Вычислите температурный коэффициент скорости реакции и ее энергию активации. Какова константа скорости этой реакции при 450 ° С?
Решение. Эмпирическая зависимость константы скорости от температуры выражается правилом Вант-Гоффа:
 ,
,
где g – температурный коэффициент.
Логарифмическая форма уравнения Вант-Гофа:
 .
.
Подставляя числовые значения, получим:
 ;
;
g = 100,132 = 1,36.
Для нахождения энергии активации воспользуемся уравнением Аррениуса в интегральной форме:
 или
или  .
.
Выразим температуру в термодинамической шкале (К) и подставим в уравнение:
 .
.
Для ответа на последний вопрос необходимо применить уравнение Аррениуса в интегральной форме:
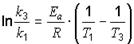 ;
;
 ;
;
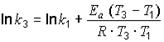 .
.
Затем возьмем для расчета одну из известных констант k1 = 3,81 при Т = 622 К и найдем k3 при Т3 = 450 + 273 = 723 К:
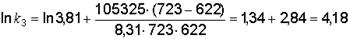 ;
;
 .
.
Ответ: g = 1,36;  ;
;  ед.
ед.
Пример 7. Реакция первого порядка при температуре 70 оС завершается на 40% за 60 мин. При какой температуре реакция завершится на 80% за 120 мин, если энергия активации равна 60 кДж/моль?
Решение. Для реакции первого порядка константа скорости выражается через степень превращения следующим образом:
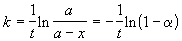 ,
,
где a = x/a - степень превращения. Запишем это уравнение при двух температурах с учетом уравнения Аррениуса:
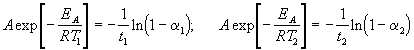 ,
,
где EA = 60 кДж/моль, T1 = 343 K, t1 = 60 мин, a 1 = 0.4, t2 = 120 мин, a 2 = 0.8. Поделим одно уравнение на другое и прологарифмируем:
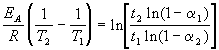
Подставляя в это выражение приведенные выше величины, находим T2 = 333 К = 60 оС.
Пример 8. Скорость бактериального гидролиза мышц рыб удваивается при переходе от температуры -1.1о С к температуре +2.2 оС. Оцените энергию активации этой реакции.
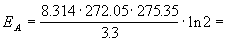 Решение. Увеличение скорости гидролиза в 2 раза обусловлено увеличением константы скорости: k2 = 2k1. Энергию активации по отношению констант скорости при двух температурах можно определить из уравнения с T1 = t1 + 273.15 = 272.05 K, T2 = t2 + 273.15 = 275.35 K:
Решение. Увеличение скорости гидролиза в 2 раза обусловлено увеличением константы скорости: k2 = 2k1. Энергию активации по отношению констант скорости при двух температурах можно определить из уравнения с T1 = t1 + 273.15 = 272.05 K, T2 = t2 + 273.15 = 275.35 K:
130800 Дж/моль = 130.8 кДж/моль.
Пример 9. В некоторой реакции 35,4 % вещества прореагировало за 60 мин. Считая эту реакцию реакцией первого порядка, вычислить, какое количество вещества (в процентах) прореагирует за 5 часов.
Решение. Определим константу скорости, используя формулу 
t = 60мин.; co=100(100%); с = (100-35,4)

Определим, какое количество вещества прореагирует за 5 часов (300 мин.).

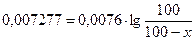

е0,95 = 8,9  100=890-8,9x 8,9x=790 x=88,76
100=890-8,9x 8,9x=790 x=88,76
Ответ. За 5 часов прореагирует 88,8% вещества.
Пример 10. Гомогенная реакция 2NO + Cl2 = 2NOCl протекает по простому механизму. Как измениться скорость прямой реакции, когда концентрация оксида азота (II) увеличиться в 2 раза?
Решение:
V = K [NO]2 [Cl2] обозначим [NO] = a, [Cl2] = b.
V1 = Ka2b, при увеличении концентрации [NO] = 2a, [Cl2] = b.
V2 = K[2a]2 [b] = 4Ka2b
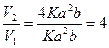
Ответ: увеличится в 4 раза.
Пример 11. Денатурация некоторого вируса является процессом первого порядка с энергией активации 630 кДж/моль. Период полураспада при температуре 300С (303 К) равен 5ч. Определите константу скорости реакции при этой температуре. Вычислите период полураспада при 400 (313 К).
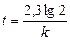
 Решение:
Решение:




K2 = 2951×0,138 = 407,2 ч-1;  или 6,12 сек
или 6,12 сек
Ответ: К2 = 407,2 ч-1, t2 = 6,12 сек
Пример 12. Было найдено, что количество свинца 206Рb, содержащегося в образце урановой руды из Восточной Сибири, эквивалентно (в молях) 41,6% урану (238U). Принимая во внимание, что весь свинец происходит из урана (период полураспада урана равен 4,5х109 лет), вычислите примерный возраст образца урановой руды.
Решение :
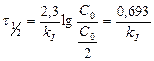

Возраст образца

Ответ: 3,5 миллиарда лет
Типовые задачи
11. Период полураспада инсектицида составляет 3 месяца. Некоторое количество его попало в водоём, где установилась концентрация 10-6 моль/л. За какое время концентрация инсектицида понизится до уровня 2,5·10-7 моль/л?
12. Во сколько раз возрастает скорость реакции разложения угольной кислоты при 310К при использовании катализатора (без катализатора энергия активации равна 86кДж/моль, а в присутствии карбоангидразы – 49кДж/моль.
13. Скорость реакции А+2В=АВ2 при концентрации А 0,4моль/л и В 0,6моль/л равна 0,12 моль/(л.мин). Определите константу скорости взаимодействия А и В и укажите ее размерность.
14. При 1500С некоторая реакция заканчивается за 16 минут. Принимая температурный коэффициент скорости реакции равным 2,5, рассчитать, через какое время закончится эта реакция, если проводить ее при 800С.
15. Во сколько раз уменьшается скорость окисления глюкозы при гипотермии, если температура тела падает с 36,6 до 270С, а температурный коэффициент данной реакции равен 1,3?
|
из
5.00
|
Обсуждение в статье: Тема 3. Основы химической кинетики |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

