 |
Главная |
Тема 2. Основы химической термодинамики
|
из
5.00
|
Основные понятия: функция состояния, тепловой эффект химической реакции; экзотермическая реакция; эндотермическая реакция; энтальпия химической реакции, энтальпия образования вещества, стандартное состояние вещества; энтропия химической реакции; энергия Гиббса химической реакции, энергия Гиббса образования вещества; закон Гесса и следствия из него; стандартные условия (с.у.).
Основные расчётные формулы:
Изменение энтропии при стандартных условиях в химической реакции определяется разностью сумм стандартных энтропий продуктов реакции и исходных веществ, с учетом соответствующих коэффициентов:
DS0р-ции = Sni S0 прод. р-ции - Sni S0 исх. в-в
где ni – стехиометрический коэффициент в уравнении реакции
Изменение энергии Гиббса в ходе химической реакции равно алгебраической сумме энергий Гиббса образования стехиометрического количества продуктов за вычетом алгебраической суммы энергий Гиббса образования стехиометрического количества реагентов:
DG0р-ции = Sni G0f прод. р-ции – Sni G0f исх. в-в
где ni – стехиометрический коэффициент в уравнении реакции
При протекании химических реакций (в том числе в живом организме) самопроизвольно идут те процессы, в которых изменение свободной энергии будет отрицательным (– DG). Такие процессы называются экзергоническими. Процессы, для которых DG является величиной положительной, называются эндергоническими. Эти процессы не могут происходить самопроизвольно. При протекании эндергонических процессов необходим приток энергии извне.
Изменение энтальпии в ходе химической реакции (тепловой эффект химической реакции) равно алгебраической сумме энтальпий образования стехиометрического количества продуктов за вычетом алгебраической суммы энтальпий образования стехиометрического количества реагентов:
DН0р-ции = Sni Н0f прод. р-ции – Sni Н0f исх. в-в
где ni – стехиометрический коэффициент в уравнении реакции
Если известны не энтальпии образования, а энтальпии сгорания (только для органических веществ), то изменение энтальпии в ходе химической реакции (тепловой эффект химической реакции) равно алгебраической сумме энтальпий образования стехиометрического количества реагентов за вычетом алгебраической суммы энтальпий образования стехиометрического количества продуктов.
DН0р-ции = Sni Н0сг исх. в-в – Sni Н0сг прод. р-ции
где ni – стехиометрический коэффициент в уравнении реакции
Энергии Гиббса и энтальпии образования простых веществ равны 0 кДж/моль.
Все три функции состояния связаны между собой следующим выражением
DG0р-ции = DН0р-ции – Т×DS0р-ции
где Т – температура, К
Т = t + 273, где t – температура в °С.
Обратите внимание, что DG0 и DН0 измеряются, как правило, в кДж/моль, а энтропия (S) – в Дж/(моль×К). При проведении расчёта не забывайте перевести Дж в кДж: 1 Дж = 1×10–3кДж.
Пример 3. Определите тепловой эффект реакции синтеза диэтилового эфира, применяемого в медицине для наркоза, при 298 К:
2С2Н5ОН(Ж) ® С2Н5ОС2Н5(ж) + Н2О(ж)
если известны стандартные энтальпии сгорания веществ, участвующих в реакции:
DН0сгор(С2Н5ОС2Н5(ж))= - 2727 кДж/моль;
DН0сгор(С2Н5ОН(ж))= - 1371 кДж/моль;
DН0сгор(Н2О(ж))= 0 кДж/моль.
Решение:
Согласно второму следствию из закона Гесса, тепловой эффект химической реакции равен разности между суммой теплот сгорания исходных веществ и суммой теплот сгорания продуктов реакции с учетом стехиометрических коэффициентов:
DН0р-ции= 2DН0сгор(С2Н5ОН(ж) – (DН0сгор(С2Н5ОС2Н5(ж)) +
+ DН0сгор(Н2О(ж)) = 2∙(-1371) – (– 2727 + 0) = – 15 кДж/моль.
Ответ: тепловой эффект синтеза диэтилового эфира составляет – 15 кДж/моль.
Пример 4. Вычислите энтропию реакции при стандартных условиях:
СН2(NH2)COOH(p-p) + СН2(NH2)COOH(p-p) ® СН2(NH2)CONHСН2COOH(p-p) + H2O(ж)
Решение:
Изменение энтропии при стандартных условиях в химической реакции определяется разностью сумм стандартных энтропий продуктов реакции и исходных веществ, с учетом соответствующих коэффициентов:
DS0р-ции = Sni S0 прод. р-ции - Sni S0 исх. в-в = (231 + 70) - (159 + 159) = 301 - 318 = – 17 Дж/(моль∙К).
Ответ: DS0р-ции = – 17 Дж/(моль∙К), т.е. энтропия уменьшается.
Пример 5. Вычислите энергию Гиббса, являющуюся критерием самопроизвольности процессов, для реакции гликолиза при стандартных условиях:
С6Н12О6 (р-р) ® 2 С3Н6О3 (р-р)
молочная кислота
Решение:
Энергия Гиббса реакции равна алгебраической сумме энергий Гиббса образования стехиометрического количества продуктов за вычетом алгебраической суммы энергий Гиббса образования стехиометрического количества реагентов:
DG0р-ции = Sni G0 прод. р-ции – Sni G0 исх. в-в = 2·(–539) – (–917) = – 161 кДж/моль.
Ответ: DG0р-ции = – 161 кДж/моль, реакция экзергоническая, протекает самопроизвольно при стандартных условиях.
Пример 6. Константа скорости реакции СО(г) + Cl2(г) = СОCl2(г) при 349 °С равна 3,81 ед., а при 395 ° С – 15,5 ед. Вычислите температурный коэффициент скорости реакции и ее энергию активации. Какова константа скорости этой реакции при 450 ° С?
Решение. Эмпирическая зависимость константы скорости от температуры выражается правилом Вант-Гоффа:
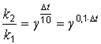 ,
,
где g – температурный коэффициент.
Логарифмическая форма уравнения Вант-Гофа:
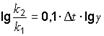 .
.
Подставляя числовые значения, получим:
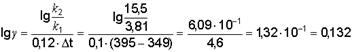 ;
;
g = 100,132 = 1,36.
Для нахождения энергии активации воспользуемся уравнением Аррениуса в интегральной форме:
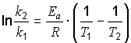 или
или 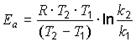 .
.
Выразим температуру в термодинамической шкале (К) и подставим в уравнение:
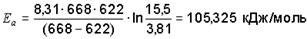 .
.
Для ответа на последний вопрос необходимо применить уравнение Аррениуса в интегральной форме:
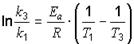 ;
;
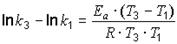 ;
;
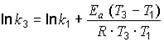 .
.
Затем возьмем для расчета одну из известных констант k1 = 3,81 при Т = 622 К и найдем k3 при Т3 = 450 + 273 = 723 К:
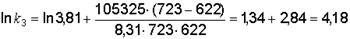 ;
;
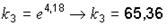 .
.
Ответ: g = 1,36; 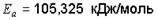 ;
; 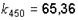 ед.
ед.
Пример 7. Реакция первого порядка при температуре 70 оС завершается на 40% за 60 мин. При какой температуре реакция завершится на 80% за 120 мин, если энергия активации равна 60 кДж/моль?
Решение. Для реакции первого порядка константа скорости выражается через степень превращения следующим образом:
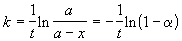 ,
,
где a = x/a - степень превращения. Запишем это уравнение при двух температурах с учетом уравнения Аррениуса:
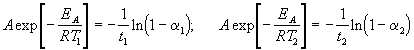 ,
,
где EA = 60 кДж/моль, T1 = 343 K, t1 = 60 мин, a 1 = 0.4, t2 = 120 мин, a 2 = 0.8. Поделим одно уравнение на другое и прологарифмируем:
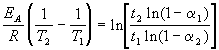
Подставляя в это выражение приведенные выше величины, находим T2 = 333 К = 60 оС.
Пример 8. Скорость бактериального гидролиза мышц рыб удваивается при переходе от температуры -1.1о С к температуре +2.2 оС. Оцените энергию активации этой реакции.
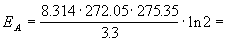 Решение. Увеличение скорости гидролиза в 2 раза обусловлено увеличением константы скорости: k2 = 2k1. Энергию активации по отношению констант скорости при двух температурах можно определить из уравнения с T1 = t1 + 273.15 = 272.05 K, T2 = t2 + 273.15 = 275.35 K:
Решение. Увеличение скорости гидролиза в 2 раза обусловлено увеличением константы скорости: k2 = 2k1. Энергию активации по отношению констант скорости при двух температурах можно определить из уравнения с T1 = t1 + 273.15 = 272.05 K, T2 = t2 + 273.15 = 275.35 K:
130800 Дж/моль = 130.8 кДж/моль.
Пример 9. В некоторой реакции 35,4 % вещества прореагировало за 60 мин. Считая эту реакцию реакцией первого порядка, вычислить, какое количество вещества (в процентах) прореагирует за 5 часов.
Решение. Определим константу скорости, используя формулу 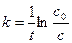
t = 60мин.; co=100(100%); с = (100-35,4)
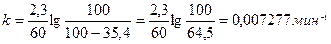
Определим, какое количество вещества прореагирует за 5 часов (300 мин.).
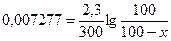
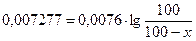
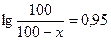
е0,95 = 8,9 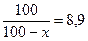 100=890-8,9x 8,9x=790 x=88,76
100=890-8,9x 8,9x=790 x=88,76
Ответ. За 5 часов прореагирует 88,8% вещества.
Пример 10. Гомогенная реакция 2NO + Cl2 = 2NOCl протекает по простому механизму. Как измениться скорость прямой реакции, когда концентрация оксида азота (II) увеличиться в 2 раза?
Решение:
V = K [NO]2 [Cl2] обозначим [NO] = a, [Cl2] = b.
V1 = Ka2b, при увеличении концентрации [NO] = 2a, [Cl2] = b.
V2 = K[2a]2 [b] = 4Ka2b
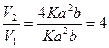
Ответ: увеличится в 4 раза.
Пример 11. Денатурация некоторого вируса является процессом первого порядка с энергией активации 630 кДж/моль. Период полураспада при температуре 300С (303 К) равен 5ч. Определите константу скорости реакции при этой температуре. Вычислите период полураспада при 400 (313 К).
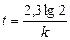
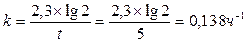 Решение:
Решение:
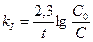
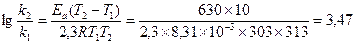
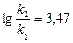
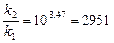
K2 = 2951×0,138 = 407,2 ч-1; 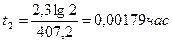 или 6,12 сек
или 6,12 сек
Ответ: К2 = 407,2 ч-1, t2 = 6,12 сек
Пример 12. Было найдено, что количество свинца 206Рb, содержащегося в образце урановой руды из Восточной Сибири, эквивалентно (в молях) 41,6% урану (238U). Принимая во внимание, что весь свинец происходит из урана (период полураспада урана равен 4,5х109 лет), вычислите примерный возраст образца урановой руды.
Решение :
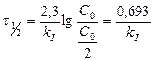
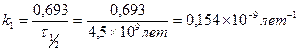
Возраст образца
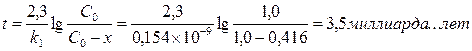
Ответ: 3,5 миллиарда лет
Типовые задачи по теме 2.
6. Определите тепловой эффект реакции синтеза диэтилового эфира, применяемого в медицине для наркоза, при 298 К, если известны стандартные энтальпии сгорания веществ, участвующих в реакции:
∆Носгор (С2Н5ОС2Н5 (ж)) = - 2727 кДж/моль;
∆Носгор (С2Н5ОН (ж)) = - 1371 кДж/моль;
∆Носгор (Н2О(ж)) = 0 кДж/моль;
7. Вычислите DG0р-ции гидратации β-лактоглобулина при 25°С; если DН0р-ции = –6,75 кДж/моль; DS0р-ции = –9,74 Дж/(моль·К).
8. Ферментативная реакция дегидрирования пропанола-2 протекает по уравнению:
СНзСНОНСНз(р-р) 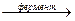 СНзСОСНз(р-р) + Н2(г)
СНзСОСНз(р-р) + Н2(г)
Определите тепловой эффект этой реакции по теплотам сгорания: DН0сгор (СН3СНОНСН3) = -2002 кДж/моль; DН0сгор(СН3СОСН3) = -1789кДж/моль; DН0сгор (Н2) = -285 кДж/моль.
9. Определите значение энтальпии реакции гидролиза мочевины –одного из важнейших продуктов жизнедеятельности организма – при 298 К, если известны стандартные энтальпии образования веществ, участвующих в реакции:
∆Нообр (СО(NH2)2(р-р)) = - 319,2 кДж/моль;
∆Нообр (H2О) (ж)) = - 285,8 кДж/моль;
∆Нообр (СО2(водн)) = - 413,6 кДж/моль;
∆Нообр (NH3) (водн)) = - 79,9 кДж/моль.
10. Вычислите энергию Гиббса тепловой денатурации трипсина при 50 0С, если при 250С ∆Нореак = 283 кДж/моль, а ∆Sообр, 298 = 288 Дж/(моль*К). С читать, что изменение энтальпии и энтропии не зависят от температуры в данном диапозоне.
|
из
5.00
|
Обсуждение в статье: Тема 2. Основы химической термодинамики |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

