 |
Главная |
Тема 5. Свойства растворов.
|
из
5.00
|
Основные понятия: закон Рауля, изменение температур фазовых переходов растворов, осмотическое давление, изотонический коэффициент, осмолярность, гипо-, гипер- и изотонические растворы
Свойства растворов (температура замерзания и кипения, давление насыщенного пара, осмотическое давление) зависят от природы растворителя и концентрации раствора и называются коллигативными свойствами, так как не зависят от природы растворенного вещества.
Изотонические растворы (изоосмотические растворы) — растворы, имеющие одинаковое осмотическое давление. Если два раствора не изотоничны, то раствор с большим осмотическим давлением называют гипертоническим, а раствор с меньшим осмотическим давлением — гипотоническим. В физиологии и медицине изотоническими принято называть растворы, осмотическое давление которых равно осмотическому давлению крови, лимфы. Попадая в организм, изотонические растворы не нарушают нормального функционирования клеток и тканей. Изотонические растворы хлорида натрия вводят внутривенно для увеличения кровяного давления после больших кровопотерь, для возмещения объема жидкости в организме при сильном обезвоживании (ожоговая болезнь, обильные рвоты и т. п.). Изотонические растворы, приближающиеся по составу, величине рН, буферным и другим свойствам к сыворотке крови, называемые физиологическими растворами, используются в качестве кровезаменителей.
Если эритроциты попали в среду с осмотическим давлением ниже, чем у крови происходит осмотический гемолиз. Вода входит в эритроциты, они набухают и лопаются. Концентрация хлорида натрия, при которой происходит гемолиз 50% всех эритроцитов, является мерой их осмотической стойкости. Ее определяют в клинике для диагностики заболеваний печени, анемий. Осмотическая стойкость должна быть не ниже 0,46% NaCl. При помещении эритроцитов в среду, с большим чем у крови осмотическим давлением, происходит плазмолиз. Это сморщивание эритроцитов. Его используют для подсчета эритроцитов.
Очевидно, что изотонические растворы содержат одинаковое количество осмотически активных частиц, концентрацию которых выражают через осмолярность (осмоляльность).
Осмолярностью (осмоляльностью) раствора называется суммарная концентрация всех кинетически активных частиц в растворе, определяющих его осмотическое давление. Осмоляльность крови и мочи создают осмотически активные электролиты (натрий, калий, хлориды), а также глюкоза, мочевина ионы аммония.
Математически величины осмолярности и осмоляльности рассчитываются следующим образом:

| ( |
Единицы измерения этих величин совпадают с единицами измерения молярной и моляльной концентрации, соответственно. В медицинской литературе эти величины принято выражать в Осмоль/л и Осмоль/кг.
В разбавленных водных растворах осмолярность и осмоляльность приблизительно равны.
Основные формулы:
Согласно закону Рауляотносительное понижение давления насыщенного пара растворителя над раствором равно молярной доле растворенного вещества в растворе. Согласно закону, понижение парциального равновесного давления насыщенного пара растворителя над раствором является линейной функцией мольной доли растворенного вещества в растворе:
 или
или
 ,
,
где  - давление насыщенного пара растворителя над раствором;
- давление насыщенного пара растворителя над раствором;  - давление насыщенного пара над индивидуальным растворителем; х1 и х2– мольные доли растворителя и растворенного вещества в растворе.
- давление насыщенного пара над индивидуальным растворителем; х1 и х2– мольные доли растворителя и растворенного вещества в растворе.
Изменение температур фазовых переходов растворов. Повышение температуры кипения
 ,
,
где 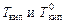 - соответственно температуры кипения раствора и индивидуального растворителя; Сm – моляльная концентрация растворенного вещества, моль/кг; Kэб – эбуллиоскопическая константа растворителя,
- соответственно температуры кипения раствора и индивидуального растворителя; Сm – моляльная концентрация растворенного вещества, моль/кг; Kэб – эбуллиоскопическая константа растворителя,  .
.
Изменение температуры кристаллизации
 ,
,
где  - соответственно температуры кристаллизации раствора и чистого растворителя; Сm – моляльная концентрация растворенного вещества; Kкр – криоскопическая постоянная растворителя,
- соответственно температуры кристаллизации раствора и чистого растворителя; Сm – моляльная концентрация растворенного вещества; Kкр – криоскопическая постоянная растворителя, 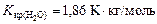 .
.
Осмотическое давление. Процесс самопроизвольного перехода растворителя в раствор через полупроницаемую мембрану называется осмосом. Давление, которое нужно приложить к раствору, чтобы осмос прекратился, называется осмотическим давлением, которое можно вычислить по формуле
 ,
,
где  – объем 1 моль растворителя, м3.
– объем 1 моль растворителя, м3.
Для электролитов необходим поправочный множитель i, названный изотоническим коэффициентом:  ;
; 
 | |||
 | |||
Изотонический коэффициент – показатель увеличения (уменьшения) числа частиц вследствие диссоциации (ассоциации). При i > 1 протекает процесс диссоциации, при i < 1 – процесс ассоциации. Численное значение изотонического коэффициента позволяет вычислить степень диссоциациии ассоциации. Соответственно
 ;
;  ,
,
где z – число частиц, получающихся из одной частицы при диссоциации; z¢ – число частиц, объединяющихся в одну при ассоциации.
Пример 12. Рассчитать изотонический коэффициент Вант-Гоффа для АlСl3, если «кажущаяся» степень диссоциации aк = 80%.
Решение. В растворе сильного электролита изотонический коэффициент рассчитывается по формуле: i = 1 + aк ∙(n – 1).
Степень диссоциации aк выражается в долях единицы и равна 0,8. Для расчета n, т.е. числа ионов, на которые диссоциирует электролит, необходимо написать уравнение диссоциации:
AlCl3  Al3+ + 3Cl-
Al3+ + 3Cl-
Таким образом: n = 4,
i = 1 + 0,8×(4 – 1) = 3,4.
Пример 13.Понижение парциального равновесного давления пара над раствором тростникового сахара (С12Н22О11) в воде составляет 2 %. Определить осмотическое давление этого раствора при температуре 47 ºС. Плотность раствора 1,15 г/см3. Определить изменение температуры плавления и кристаллизации, если Kэб = 0,52 K·кг/моль, Kкр = = 1,86 K·кг/моль, 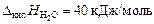 ;
;  ;
;  .
.
Решение. Из закона Рауля следует, что мольная доля сахара в растворе составляет 0,02. Определим повышение температуры кипения раствора:
 .
.
Понижение температуры замерзания раствора:
 .
.
вычислим осмотическое давление:  .
.
Пример 14. Не прибегая к расчетам, указать, какие из растворов при одинаковой температуре являются изотоническими:
а) С(NaCl) = 0,03 моль/л, a = 1 и С(С6Н12О6) = 0,03 моль/л;
б) С(CO(NH2)2) = 0,03 моль/л и С(СаС12) = 0,01 моль/л,  = 1.
= 1.
Решение.
Для растворов электролитов:  ,
,
для неэлектролитов i = l, следовательно: 
Для каждой пары растворов RT = const, следовательно, достаточно сравнить множитель i×С(x) в каждой паре растворов.
а) Хлорид натрия при диссоциации образует 2 иона, следовательно 2×0,3 ¹ 0,3 (неизотоничны);
б) Хлорид кальция при диссоциации образует 3 иона, следовательно 0,3 = 3×0,1 (изотоничны).
Пример 15. Рассчитать осмолярность клеток саксаула, если осмотическое давление при 300С равно 145 атм.
Решение.
Осмолярность раствора определим по формуле:

Типовые задачи.
21. Осмотическое давление плазмы крови человека при 37 °C находится в интервале 740–780 кПа. Какую массу глюкозы следует взять для приготовления 0,5 л раствора изотоничного плазме крови с осмотическим давлением 760 кПа? Каким по отношению к плазме крови является 0.5 М раствор NaCl (изотоническим, гипертоническим или гипотоническим)? Что будет происходить с эритроцитами в таком растворе?
22. Осмотическое давление плазмы крови при 37 °C составляет 770 кПа. Определите: а) осмолярность плазмы крови; б) молярную концентрацию CaCl2 в изотоническом плазме растворе (при одинаковой температуре).
Тема 6. Водородный показатель растворов сильных и слабых электролитов и буферных растворов
Для характеристики кислотно-основных свойств растворов используют водородный показатель рН, равный отрицательному значению десятичного логарифма концентрации ионов водорода. Аналогично рассчитывают гидроксильный показатель рОН, равный отрицательному значению десятичного логарифма концентрации ионов гидроксила:

Концентрации ионов водорода и гидроксила связаны между собой равновесием диссоциации воды:
Н2О Û Н+ + ОН-.
Константу равновесия называют ионным произведением воды. При 298 К константа равновесия
 .
.
Прологарифмировав это уравнение, получим
рН + рОН = 14.
В чистой воде (нейтральная среда) рН = рОН = 7. В кислой среде рН < 7, в щелочной среде рН > 7.
Для сильных кислот и щелочей, полностью диссоциированных на ионы,
[Н+] = zCк и [ОН-] = zCщ,
где Ск и Сщ - молярные концентрации кислоты и щелочи соответственно; z - основность кислоты или кислотность основания.
Расчет рН в растворах слабых кислот и оснований. Диссоциация многих электролитов протекает не полностью. Отношение числа диссоциированных молей к общему числу молей электролита в растворе называют степенью диссоциации. Для его количественного описания используют константу равновесия, называемую константой диссоциации. Для одноосновной кислоты, диссоциирующей по уравнению, НАn Û Н+ + Аn-, где Аn – кислотный остаток, константа диссоциации
 .
.
Так как [An–] = [H+] и [НAn] = C, то
 ;
;
 ,
,
где С – концентрация слабой кислоты, моль/л.
Для растворов слабых оснований
 ,
,
где С – концентрация слабого основания, моль/л.
По значению константы диссоциации можно рассчитать степень диссоциации слабого электролита:
 .
.
Многоосновные кислоты диссоциируют ступенчато, например: Н2S Û НS- + Н+ (1-я ступень); НS- Û S2- + Н+ (2-я ступень).
При расчетах рН обычно учитывают только первую ступень диссоциации, пренебрегая второй и третьей ступенями. Таким образом, вышеприведённые уравнения справедливы и для многоосновных кислот при использовании первой константы диссоциации Kd1.
Пример 16. Вычислить рН раствора серной кислоты концентрацией 0,3 % (d = 1,0 г/см3).
Решение. 1. Перейдем к молярной концентрации серной кислоты. Для этого выделим мысленно 100 г раствора, тогда масса серной кислоты составит 0,3 г, объём раствора составит 100 / 1 = 100 см3 = 0,1 л. Вычислим молярную концентрацию:

2. Согласно уравнению диссоциации H2SO4 ® 2H+ + SO42-, из 1 моль серной кислоты образуется 2 моль H+, следовательно, 
3. Вычислим рН = –lg[H+] = –lg0,0612 = = 1,21.
Буферные растворы – растворы, способные поддерживать определенное значение рН при разбавлении, а также при добавлении некоторых количеств сильной кислоты или щелочи. Буферное действие основано на связывании добавляемых ионов Н+ или ОН- в молекулы малодиссоциированных соединений.
Различают следующие типы буферных растворов:
· Смесь слабой кислоты и ее соли (например, уксусная кислота СН3СООН + ацетат натрия NaCH3COO). При добавлении сильной кислоты к этому раствору анионы соли связывают ионы Н+ в молекулы малодиссоциированной уксусной кислоты:
СН3СОО- + Н+ Û СН3СООН.
При добавлении щелочи протекает реакция нейтрализации:
СН3СООН + ОН- Û СН3СОО- + Н2О
и раствор имеет
 ,
,
где pKa – показатель константы диссоциации слабой кислоты или константа кислотности, pKa = –lgKa; Сс и Ск – концентрации соли и кислоты соответственно, моль/л.
· Смесь средней и кислой соли или двух кислых солей слабой многоосновной кислоты (например, Na2CO3 + NaHCO3 или Na2HPO4 + NaH2PO4). Анионы кислой соли реагируют подобно слабой кислоте:
 ,
,
где Сс и Ск – концентрации кислой и средней соли соответственно, моль/л.
· Кислые соли слабых многоосновных кислот, при добавлении к растворам которых сильных кислот или щелочей, протекают аналогичные реакции:
НСО3- + Н+ Û Н2СО3;
НСО3- + ОН- Û СО32- + Н2О;
 ,
,
где pKn – показатель константы диссоциации кислоты по соответствующей ступени.
· Смесь слабого основания и его соли (например, NH4OH + + NH4Cl). Буферное действие основано на реакциях
NH4OH + H+ Û NH4+ + H2O;
NH4+ + OH- Û NH4OH.
Показатель
 ,
,
где pKb – показатель константы диссоциации слабого основания или константа основности; Сс и Сосн – концентрации соли и основания соответственно, моль/л.
· Соли слабых кислот и слабых оснований (например, NH4CH3COO). Буферное действие обусловлено реакциями
NH4+ + OH- Û NH4OH;
CH3COO- + H+ Û CH3COOH.
Пример 17. К 0,8 л 0,5 М раствора НСООН (Kd = 1,8×10-4) добавили 0,2 л 0,4 М раствора NaOH. Вычислить рН образовавшегося формиатного буфера.
Решение. Количество вещества НСООН и NaOH соответственно


Объем буферного раствора
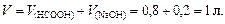
Количество вещества формиата натрия, образующегося по реакции NaOH + HCOOH ® HCOONa + H2O, 
 моль. Молярная концентрация формиата натрия в буферном растворе
моль. Молярная концентрация формиата натрия в буферном растворе
 моль/л.
моль/л.
Остаточное количество вещества муравьиной кислоты

 .
.
Ее молярная концентрация в буферном растворе
 моль/л.
моль/л.
Буферный раствор имеет

Пример 18. Сколько граммов твердого формиата натрия HCOONa надо добавить к 100 мл 0,2 М раствора соляной кислоты, чтобы получить буферный раствор с рН = 4,3?
Решение. При добавлении к раствору соляной кислоты формиата натрия образуется муравьиная кислота по реакции HCOONa + HCl ® HCOOH + NaCl. Ее концентрация
С(HCOOH) = С(HCl) = 0,2 моль/л.
Для образования формиатного буферного раствора необходима определенная концентрация формиата натрия, которую найдем исходя из формулы (4.22):
 ,
,
откуда  моль/л.
моль/л.
Количество вещества формиата натрия, необходимого для получения данного буферного раствора,
 моль,
моль,
его масса  г.
г.
Типовые задачи.
23. К 200 мл 0,5 н. раствора уксусной кислоты добавили 10 мл 0,8 н. раствора едкого натра. Определить рН полученного раствора.
24. Какой объем 20-процентного раствора уксусной кислоты плотностью 1,026 г/см3 следует прилить к 1 л 0,075 н. раствора ацетата натрия, чтобы получить буферный раствор с рН = 2,75?
25. Рассчитать рН раствора, содержащего 1,5 моль/л ацетата натрия и 0,75 моль/л уксусной кислоты. Как изменится величина рН при добавлении к 50 мл этого раствора 1 мл 2 н. раствора едкого натра?
26. К 25 мл 2-процентного раствора гидроксида аммония плотностью 0,99 г/см3 добавили 1,5 г хлорида аммония. Определить рН полученного раствора, если его плотность равна 1,01 г/см3.
27. Как изменится рН в 0,1 н. растворе уксусной кислоты после добавления к нему кристаллического ацетата натрия до концентрации 0,1 моль/л?
28. Рассчитайте объемы 0.1 M растворов CH3COOH и CH3COONa, необходимых для приготовления 100 мл буферного раствора с pH = 5.36.
29. Рассчитайте pH аммиачного буфера, образующегося при добавлении 10 мл 0.1 M раствора HCl к 40 мл 0.1 M раствора NH3 (pKB = 9.25).
Тема 7. Гидролиз
Гидролиз – процесс превращения химических соединений в результате реакции с водой. Гидролиз соли – это реакция, обратная процессу образования соли путем нейтрализации кислоты основанием:
нейтрализация Þ
НА + МОН Û МА + Н2О.
кислота основание Ü гидролиз соль вода
Гидролизуются только соли, содержащие в своем составе ионы слабых электролитов: слабой кислоты или слабого основания.
Правила составления уравнений гидролиза следующие:
1. Записывают уравнение диссоциации соли.
2. Определяют ион слабого электролита, который может гидролизоваться. Ионов сильных кислот и оснований сравнительно немного, наиболее распространенные следует запомнить: анионы NO3-, SO42-, Cl-, Br-, I-, ClO4-, катионы Na+, K+ и других щелочных металлов, а также Ba2+ и Sr2+. Перечисленные ионы не гидролизуют ся! Все остальные ионы, за редким исключением, образуют слабые электролиты и гидролизуются.
3. Составляют ионное уравнение гидролиза по схеме:
ион слабого электролита + вода Û слабый электролит + ион, оставшийся от молекулы воды.
4. Записывают молекулярное уравнение гидролиза, добавляя к ионам противоионы.
В зависимости от состава соли различают следующие типы гидролиза:
· Гидролиз соли, образованной сильным основанием и слабой кислотой (СН3СООNa, Na2CO3, R3PO4, K2SO3). Гидролизуется анион слабой кислоты.
А- + Н2О Û НА + ОН-
В растворе появляются ионы ОН-, поэтому среда – щелочная, рН > 7.
Гидролиз соли, образованной слабым основанием и сильной кислотой (NH4Cl, AlCl3, Fe(NO3)2. Гидролизуется катион слабого основания.
М+ + Н2О Û МОН + Н+.
В растворе появляются ионы Н+, поэтому среда кислая, рН < 7.
· Гидролиз соли, образованной двумя слабыми электролитами. Гидролиз протекает как по катиону, так и по аниону
М+ + А- + Н2О → МОН + НА.
Образующиеся слабые кислота и основание диссоциируют в разной степени, поэтому среда в растворе зависит от их относительной силы. Если кислота сильнее, то ее константа диссоциации больше и среда слабокислая. Если сильнее основание, то среда слабощелочная.
Вычисление количественных характеристик гидролиза производится в зависимости от того, как образована соль:
· Соль образована одним слабым электролитом. Константа гидролиза
 ,
,
где Kh1 – константа гидролиза по первой ступени, Kw – ионное произведение воды, при 298 K KW = 10-14; Kdn – константа диссоциации продукта гидролиза.
Степень гидролиза связана с константой гидролиза уравнением
 ,
,
где С – концентрация гидролизующегося иона, моль/кг.
В растворах солей, гидролизующихся по аниону, среда щелочная (см. уравнение (67)) и расчет рН ведут по формуле:
 .
.
В растворах солей, гидролизующихся по катиону, среда кислая, согласно уравнению (4.19), и расчет рН ведут по формуле
 .
.
· Соль образована двумя слабыми электролитами. Константа гидролиза
 ,
,
где Kосн и Kк – константы диссоциации основания и кислоты, образующих соль. Формула служит для расчета константы гидролиза по табличным значениям констант диссоциации.
Степень гидролиза
 .
.
Отношение концентраций ионов Н+ и ОН- в растворе соли определяется относительной силой кислоты и основания:

где Kк и Kосн – константы диссоциации слабых кислоты и основания, которыми образована соль.
Таким образом, при 298 К (KW = 10-14):

или
 .
.
Константа и степень гидролиза у соли, образованной двумя слабыми электролитами, значительно выше, чем у солей, образованных одним слабым электролитом.
Пример 19. составить молекулярное и ионное уравнения гидролиза, указать характер среды для сульфата железа (II).
Решение. Напишем уравнение диссоциации соли: FeSO4 ® ® Fe2+ + SO42-. Определим сильный и слабый электролиты. Иону Fe2+ соответствует слабое основание Fe(OH)2, иону SO42- – сильная кислота H2SO4. Следовательно, гидролиз идет по катиону.
Составим ионное уравнение гидролиза (по первой ступени): Fe2+ + HOH ® FeOH+ + H+. В ходе гидролиза образуются ионы H+, среда кислая.
Составим молекулярное уравнение гидролиза и уравняем его как обычную реакцию обмена:
2 FeSO4 + 2H2O ® (FeOH)2SO4 + H2SO4.
Пример 20. составить молекулярное и ионное уравнения гидролиза, указать характер среды для карбоната калия.
Решение. Напишем уравнение диссоциации соли: K2CO3 ® ® K+ + CO32-. Определим сильный и слабый электролиты. Иону K+ соответствует сильное основание KOH, иону CO32- – слабая кислота H2CO3. Следовательно, гидролиз идет по аниону.
Составим ионное уравнение гидролиза (по первой ступени): CO32- + HOH ® HCO3- + OH-. В ходе гидролиза образуются ионы OH-, среда в растворе щелочная.
Составим молекулярное уравнение гидролиза и уравняем его как обычную реакцию обмена:
K2CO3 + H2O ® KHCO3 + KOH.
Пример 21. составить молекулярное и ионное уравнения гидролиза, указать характер среды для нитрита аммония.
Решение. Напишем уравнение диссоциации соли: NH4NO2 ® ® NH4+ + NO2-. Определим сильный и слабый электролит. Иону NH4+ соответствует слабое основание NH4OH, иону NO2- – слабая кислота HNO2. Следовательно, гидролиз идет как по катиону, так и по аниону. Составим ионное уравнение гидролиза:
NH4+ + NO2- + HOH ® NH4OH + HNO2.
Составим молекулярное уравнение гидролиза и уравняем его как обычную реакцию обмена:
NH4NO2 + H2O ® NH4OH + HNO2.
Пример 22. Вычислить рН раствора сульфата аммония концентрацией 0,1 моль/л.
Решение. Составим ионное уравнение гидролиза: NH4+ + H2O ® NH4OH + H+. Значение константы диссоциации гидроксида аммония Kd = 1,76×10-5. Вычислим константу гидролиза

Найдем концентрацию ионов аммония. Согласно уравнению диссоциации сульфата аммония (NH4)2SO4 ® 2 NH4+ + SO42-,
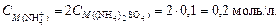
Вычислим концентрацию ионов

и
рН = –lg[H+] = –lg(1,066×10-5) = 4,97.
Пример 23. вычислить степень гидролиза карбоната натрия в растворе с рН = 12.
Решение. Составим ионное уравнение гидролиза: CO32- + + H2O ® HCO3- + OH-. Вторая константа диссоциации угольной кислоты Kd2 = 4,69×10-11. Первая константа гидролиза по уравнению (4.20)
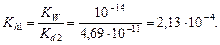
Из формулы 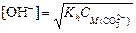 найдем концентрацию карбонат-иона
найдем концентрацию карбонат-иона
 ,
,
где [OH-] = 10-pOH = 10-(14-12) = 10-2.
Вычислим степень гидролиза

Типовые задачи.
30. составить молекулярное и ионное уравнения гидролиза, указать характер среды для нитрата железа (III), сульфита натрия, ацетата свинца (II), хлорида алюминия, сульфида натрия.
|
из
5.00
|
Обсуждение в статье: Тема 5. Свойства растворов. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

