 |
Главная |
Электроды первого рода.
|
из
5.00
|
Термодинамическая константа диссоциации и степень диссоциации электролита в растворе, зависимость этих характеристик от различных факторов. Изменятся ли (и если да, то как) названные величины для уксусной кислоты в водном растворе, если в раствор добавить ацетат натрия CH3COONa? Приведите обоснование ответа.
Константа равновесия диссоциации слабого электролита называется константой диссоциации (К). Величина К зависит от природы электролита и растворителя, а также от температуры. Термодинамическая константа диссоциации, выраженная через активность ионов и молекул, не зависит от концентрации.

Степень диссоциации- отношение числа продиссоциировавших молекул электролита в растворе к общему числу его молекул
α = (Nд/N)·100%
От чего зависит величина степени диссоциации:
· от природы растворителя - степень диссоциации тем выше, чем выше полярность растворителя;
· от температуры - степень диссоциации тем выше, чем выше температура;
· от концентрации - степень диссоциации тем выше, чем ниже концентрация растворенного вещества (более разбавленный раствор);
· от природы электролита - степень диссоциации тем выше, чем полярней связи в молекулах, по которым происходит диссоциация.
слабые электролиты (α<3%): в водных растворах диссоциируют не полностью, при этом процесс диссоциации слабых электролитов является обратимым:
Как изменится степень диссоциации уксусной кислоты, если в её раствор добавить ацетат натрия? Почему?
Решение. Если к раствору уксусной кислоты добавить ацетат натрия, практически нацело диссоциирующий по уравнению:
CH3COONa = Na+ + CH3COO-,
то концентрация ацетат-иона в растворе возрастет. Согласно принципу Ле Шателье, увеличение концентрации ионов CH3COO- будет сопровождаться уменьшением концентрации ионов водорода, т.е. смещением равновесия в сторону процесса ассоциации:
CH3COOН  Н+ + CH3COO-.
Н+ + CH3COO-.
Таким образом, одноименные ионы подавляют ионизацию слабых электролитов.
Константа диссоциации и степень диссоциации слабого электролита в растворе. Изменятся ли (и если да, то как) термодинамическая константа диссоциации и степень диссоциации бензойной кислоты C6H5COOH в водном растворе, если в раствор ввести сильную кислоту? Дайте обоснованный ответ.
Чем больше константа диссоциации, тем сильнее диссоциирует электролит, т.е., он легче распадается на ионы, которых в растворе становится много, и электролит становится сильным.
В растворе слабого электролита устанавливается равновесие, когда скорость диссоциации в растворе равна скорости ассоциации
KA ↔ K+ + A-
K д = ([K+][A-])/[KA]
· [K+] - молярная равновесная концентрация катионов;
· [A-] - молярная равновесная концентрация анионов;
· [KA] - молярная равновесная концентрация недиссоциированных молекула электролита.
В отличие от степени диссоциации константа диссоциации (для слабого электролита) не зависит от концентрации раствора.
Степень диссоциации и константа диссоциации связаны соотношением (c - молярная концентрация электролита):
Kд = (α2·c)/(1-α)
Для слабых электролитов константа диссоциации мала, поэтому, ею можно пренебречь:
Kд = α2·c
α = √(Kд/c)
Для сильных электролитов константа диссоциации является переменной величиной, зависящей от концентрации раствора.
Константа и степень диссоциации слабой кислоты в присутствие сильной увеличивается, т.к. увеличивается количество ионов водорода.
Кд=[Н+][А-]/[НА] Н+> => Kд>
Вывод и анализ выражения закона разведения Оствальда для электролита валентного типа «1-1». Влияние концентрации и температуры на константу диссоциации и степень диссоциации слабых электролитов.
CH3COOH -><- CH3COO-+H+ (С пропорциональна активности, т.к. электролит слабый)
С`(продиссациировало)=α*С;
C``(осталось)=С(1-α)
Kd =С2α2/С(1-α) – C сокращаются
Kd =С*α2/(1-α) – закон разведения Оствальда
Сформулируйте основные положения теории электролитической диссоциации Аррениуса. Константа диссоциации, степень диссоциации. Назовите основные причины, вызывающие диссоциацию растворенных веществ на ионы в растворе. От каких факторов зависит степень диссоциации?

Вопросы про Кд и α выше
Сильные и слабые электролиты. Количественные характеристики диссоциации: степень диссоциации, константа диссоциации, их зависимость от концентрации, температуры, природы растворителя.
Электролиты — вещества, расплавы или растворы которых могут проводить электрический ток.
Сильные электролиты — это вещества, которые при растворении в воде почти полностью диссоциируют на ионы.
Поэтому в уравнениях диссоциации ставят знак равенства (=) для сильных электролитов.
Слабые электролиты — это такие вещества, которые только частично диссоциируют на ионы.
Поэтому в уравнениях диссоциации ставят знак обратимости (⇄) для слабых электролитов.

Проводники электрического тока I и II рода. Удельная, молярная и эквивалентная электрические проводимости, связь между ними. Зависимость удельной и эквивалентной электрических проводимостей от концентрации.
Проводники – вещества, проводящие электрический ток благодаря наличию в них большого количества зарядов, способных свободно перемещаться (в отличие от изоляторов). Они бывают I (первого) и II (второго) рода. Электропроводность проводников I рода не сопровождается химическими процессами, она обусловлена электронами. К проводникам I рода относятся: чистые металлы, т. е. металлы без примесей, сплавы, некоторые соли, оксиды и ряд органических веществ. На электродах, выполненных из проводников I рода, происходит процесс переноса катиона металла в раствор или из раствора на поверхность металла.
К проводникам II рода относятся электролиты. В них прохождение тока связано с химическими процессами и обусловлено движением положительных и отрицательных ионов.
Электроды первого рода.
Серебряный электрод первого рода Ag+/Ag. Ему отвечает реакция Ag+ + e- = Ag и электродный потенциал
EAg+ /Ag = Ag+ / Ag+b0lg a Ag+.
Электроды второго рода Схематически электрод второго рода можно представить так: АZ–/MA, M, а протекающую в нем реакцию – МА + ze = М + АZ–.
Количественной характеристикой способности растворов проводить электрический ток служит электрическая проводимость.
 , где k =1/r – удельная электрическаяпроводимость.
, где k =1/r – удельная электрическаяпроводимость.
Удельная электрическая проводимость раствора электролита– это электрическая проводимость объема раствора, заключенного между двумя параллельными электродами, имеющими площадь по одному квадратному метру и расположенными на расстоянии одного метра друг от друга.
Удельная электрическая проводимость является величиной, обратной дельному сопротивлению r:
 Удельное сопротивление определяется по уравнению
Удельное сопротивление определяется по уравнению
 где R — общее сопротивление проводника, Ом; l – длина проводника, м; s – поперечное сечение проводника, м2. Из уравнения имеем
где R — общее сопротивление проводника, Ом; l – длина проводника, м; s – поперечное сечение проводника, м2. Из уравнения имеем
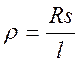
Удельная электрическая проводимость выражают в Ом–1м–1 (основная единица), или См*м–1 (1 Ом–1 = 1 См – Сименс). Зависит от многих факторов: природы электролита, его концентрации и температуры.

Повышение температуры на 1К увеличивает удельную электрическую проводимость примерно на 2–2,5 %. Это объясняется понижением вязкости раствора и уменьшением гидратации ионов, а для растворов слабых электролитов увеличением их степени диссоциации.
Удельная электрическая проводимость максимальна у растворов сильных кислот, несколько меньше у растворов сильных оснований, что объясняется полной диссоциацией этих электролитов. При снижении концентрации электролита до очень малых значений (при с ® 0) электрической проводимости растворов стремится к электрической проводимости чистой воды.
При изучении электрической проводимости растворов целесообразно пользоваться молярной электрической проводимостью l.
Молярная электрическая проводимость –равна удельной электрической проводимости его раствора с концентрацией 1 моль/м3.
Удельная и молярная электрические проводимости связаны между собой соотношением:.
 где с – молярная концентрация в моль/л.
где с – молярная концентрация в моль/л.
 Зависимость молярной электрической проводимости от концентрации электролита
Зависимость молярной электрической проводимости от концентрации электролита
Молярная электрическая проводимость уменьшается при увеличении концентрации электролита. В растворах сильных электролитов это связано с тем, что при увеличении концентрации усиливается межионное взаимодействие и скорость движения ионов при этом уменьшается. Число ионов в разбавленных растворах при этом не изменяется, так как для определения молярной электрической проводимости всегда берется такой объем раствора, в котором находится 1 моль электролита. При значительных концентрациях возможна ионная ассоциация, приводящая к уменьшению числа токопроводящих частиц, и следовательно, к уменьшению электропроводности.
В случае слабых электролитов при возрастании концентрации уменьшается степень диссоциации, и число ионов в объеме раствора уменьшается.
. Часто указывают электрическую проводимость частицы, которая соответствует ее химическому эквиваленту, т.е. концентрация выражается в единицах нормальности. Поэтому используется также понятие эквивалентной электрической проводимостиl*: (см 25 билет)
 , (17.5)
, (17.5)
где n+ и n– – число катионов и анионов, образующихся при диссоциации молекулы, а z+ и z– – их заряды.
Вывод закона разведения Оствальда для слабого электролита, молекулы которого диссоциируют в разбавленном водном растворе на два иона. Константа электролитической диссоциации, степень диссоциации. Запишите полученное уравнение с использованием величины эквивалентной электропроводности.
CH3COOH -><- CH3COO-+H+ (С пропорциональна активности, т.к. электролит слабый)
С`(продиссациировало)=α*С;
C``(осталось)=С(1-α)
Kd =С2α2/С(1-α) – C сокращаются
Kd =С*α2/(1-α) – закон разведения Оствальда
α= 
Кд=α2С / (1-α)= (  )2С/ (1-
)2С/ (1-  ) = Л2С/(Л∞( Л∞-Л)
) = Л2С/(Л∞( Л∞-Л)
Измерение электрической проводимости как метод исследования термодинамических свойств растворов электролитов и ионных равновесий. Определение степени диссоциации и константы диссоциации слабых электролитов в растворах.
Зависимость константы равновесия диссоциации от температуры описывается уравнением изобары Вант-Гоффа

Константа диссоциации слабого электролита связана со степенью диссоциации. Обозначим: С – исходная концентрация электролита, α – степень диссоциации. Тогда концентрация ионов в состоянии равновесия для бинарного электролита Сα. Концентрация недиссоциированных молекул будет: (С – С∙α) = С (1–α).
Константу диссоциации для уксусной кислоты можно представить следующим образом:
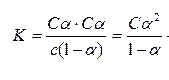 -закон разведения Оствальда.
-закон разведения Оствальда.
В слабых электролитах величина α << 1. Поэтому значением α можно пренебречь и величину (1-α) принять равной 1. Тогда K=Cα2,  т.е. степень диссоциации слабых электролитов обратно пропорциональна квадратному корню из концентрации.
т.е. степень диссоциации слабых электролитов обратно пропорциональна квадратному корню из концентрации.
 Таким образом, закон разбавления Оствальда формулируется следующим образом: степень диссоциации электролита при разбавлении раствора увеличивается.
Таким образом, закон разбавления Оствальда формулируется следующим образом: степень диссоциации электролита при разбавлении раствора увеличивается.
|
из
5.00
|
Обсуждение в статье: Электроды первого рода. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

