 |
Главная |
Химические цепи без переноса (приведите пример). Зависимость ЭДС
|
из
5.00
|
Химических цепей без переноса от активности потенциалопределяющих ионов в
Растворе. Вывод и анализ уравнения Нернста.
Электрохимические цепи по наличию или отсутствию в цепи границы двух различных растворов (а значит и диффузионного потенциала) разделяют на цепи с переносом или без переноса соответственно.
В химических цепях источником электрической энергии является химическая реакция, протекающая в электрохимической системе. Химические цепи могут быть с переносом (имеется граница двух растворов или соединение через солевой мостик) и без переноса, где такой границы нет. Химические цепи построены из электродов различных по химической природе.
В гэ без переноса нет диффузионного потенциала, следовательно его не надо устранять. Точность измерения выше.
Примеры цепей без переноса:
Pt, Cl2 | KCl | AgCl(тв), Ag

Концентрационные цепи без переноса, приведите примеры. Для произвольно выбранного концентрационного элемента названного типа запишите химический процесс, протекающий в элементе. Вывод уравнения Нернста для расчёта ЭДС этого элемента.
Различают концентрационные цепи с переносом и без переноса.
Цепи без переноса строят из двух амальгамных электродов с разной концентрацией амальгам, сплавов или двух газовых электродов с разными давлениями газов, погруженных в один и тот же раствор. В этих цепях на электроде с большей концентрацией амальгамы, сплава или с большим давлением газа происходит ионизация атомов металла или газа, активность металла или газа уменьшается. На электроде с меньшей концентрацией будет происходить образование свободных атомов металла или молекул газа, их активность возрастает. Таким образом, в результате работы концентрационной цепи происходит выравнивание активностей компонентов на обоих электродах. Как и в химических цепях, электрод, на котором идет восстановление (присоединение электронов), будет положительным, где окисление – отрицательным.
Pt | Cl2 | KCl | Cl2 | Pt
P'(Cl2)<P"(Cl2)
½Cl2 (P") + ē = Cl-
Cl- = ½Cl2 (P')
Cl2(P")=Cl2(P')
E= -(RT/zF)*ln(P'/P")
71) Классификация гальванических элементов. Примеры концентрационных цепей. Уравнение Нернста для концентрационного элемента, составленного из двух амальгамных электродов. Определение полярности электродов.
Электрические цепи обычно классифицируют по двум признакам:
1) по источнику электрической энергии они делятся на химические и концентрационные;
2) по наличию или отсутствию в цепи границы двух различных растворов (а значит и диффузионного потенциала) на цепи с переносом или без переноса соответственно.
В химических цепях источником электрической энергии является химическая реакция, протекающая в электрохимической системе. Химические цепи могут быть с переносом (имеется граница двух растворов или соединение через солевой мостик) и без переноса, где такой границы нет. Химические цепи построены из электродов различных по химической природе.
В концентрационных цепях оба электрода идентичны как по физической природе, так и по химической природе участников окислительно–восстановительных процессов. Они отличаются только концентрациями компонентов. Знаки электродов определяются по реакциям на электродах, приводящим к выравниванию концентраций (активностей) веществ электродов.
Различают концентрационные цепи с переносом и без переноса.
Цепи без переноса строят из двух амальгамных электродов с разной концентрацией амальгам, сплавов или двух газовых электродов с разными давлениями газов, погруженных в один и тот же раствор. В этих цепях на электроде с большей концентрацией амальгамы, сплава или с большим давлением газа происходит ионизация атомов металла или газа, активность металла или газа уменьшается. На электроде с меньшей концентрацией будет происходить образование свободных атомов металла или молекул газа, их активность возрастает. Таким образом, в результате работы концентрационной цепи происходит выравнивание активностей компонентов на обоих электродах. Как и в химических цепях, электрод, на котором идет восстановление (присоединение электронов), будет положительным, где окисление – отрицательным.
Концентрационная цепь с переносом:
Ag | AgNO3 :: AgNO3 | Ag
Амальгамный гэ:
Zn (Hg) | ZnSO4 | Zn(Hg)
a1>a2
В процессе выравнивания концентраций на правом электроде будет происходить образование (восстановление) цинка по реакции:
Zn(2+)+2ē = Zn (Hg) (a2)
Следовательно он положительный.
На левом – растворение (окисление) цинка:
Zn (Hg) (a1) = Zn(2+)+2ē
Следовательно он отрицательный.
Zn (Hg) (a1) = Zn (Hg) (a2)
E= -(RT/zF)*ln(a2/a1) > 0
72) . Концентрационные гальванические элементы, составленные из двух электродов первого рода, электрохимическая цепь с переносом. Уравнение Нернста для расчета ЭДС элемента. Дайте обоснование приведенного уравнения.
Концентрационная цепь с переносом:
(-)Ag | AgNO3 :: AgNO3 | Ag (+)
a1<a2
В ходе работы этого элемента активности должны выравниваться, т.е. а1 возрастать, а а2 убывать
(a2)Ag(+)+ē = Ag
Ag = (a1)Ag(+)+ē
(a2)Ag(+) = (a1)Ag(+)
E = (RT/zF)*ln(a2/a1) > 0
73) Концентрационные гальванические элементы. Приведите пример концентрационного гальванического элемента, составленного из двух электродов второго рода. Как определить полярность электродов данного элемента? Запишите уравнение Нернста для представленного элемента и дайте необходимые пояснения.
выводила сама, не уверена
(-) Ag | AgBr | Br(-) :: Br (-) | AgBr | Ag (+)
а1(Br-)>а2(Br-)
Окисление (отрицательный)
Ag+ (а1) Br (-)= AgBr + ē
Восстановление (положительный)
AgBr + ē= Ag +(а2) Br(-)
(а1) Br (-) = (а2) Br(-)
E = - (RT/zF)*ln(a2/a1)
Зависимость ЭДС гальванического элемента от температуры. Определение изменения термодинамических функций окислительно-восстановительных реакций потенциометрическим методом. Проиллюстрируйте процедуру расчета на произвольном примере


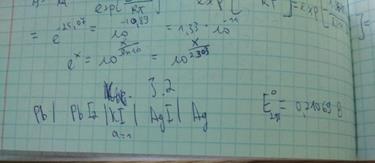


Предложите гальванический элемент, с помощью которого возможно определить средний ионный коэффициент активности соли AB (дан конкретный сильный электролит) в водном растворе. Получите выражение для расчета коэффициента активности
1)

2)

3)

Предложите гальванический элемент, с помощью которого возможно определить средний ионный коэффициент активности соли AB (дан конкретный сильный электролит) в водном растворе. Получите выражение для расчета коэффициента активности.
Средний коэффициент активности электролита и, следовательно, среднюю активность электролита можно определить методом измерения электродвижущих сил гальванических элементов без переноса. Для этого используют элемент, составленный из электродов, один из которых обратим по отношению к катионам, а другой – по отношению к анионам соединения. Электроды опускают в один и тот же раствор электролита.
Пример, Ag|Zn|ZnCl2(р-р)|AgCl|Ag
E=E°- 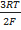 lna±(ZnCl2) ; a±(ZnCl2) =γ (Zn2+) *m (ZnCl2) ; E=E°-
lna±(ZnCl2) ; a±(ZnCl2) =γ (Zn2+) *m (ZnCl2) ; E=E°- 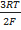 lnγ(Zn2+) -
lnγ(Zn2+) - 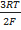 lnm(ZnCl2)
lnm(ZnCl2)
lnγ (ZnCl2) = 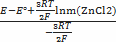
Примеры,


Предложите гальванический элемент, с помощью которого можно определить рН исследуемого раствора. Запишите уравнение Нернста для каждого из электродов электрохической цепи. Получите уравнение для расчета рН раствора.
При измерении рН р-ра в качестве индикаторного электрода обычно используют стеклянный, электродом сравнения мб хлорсеребряный или каломельный электрод.
Если в качестве электрода сравнения применить хлорсеребряный, то электрохимическая цепь будет иметь вид:
Cu|Ag,AgCl|HCl(р-р, 0,1M)|стекло|исследуемый р-р(a H+)¦¦KCl|AgCl,Ag|Cu.
E=E cl|AgCl|Ag –Eст
Eст = E ст°- 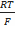 lna(H+) и рН =
lna(H+) и рН = 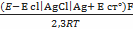
Пример, 
Составьте гальванический элемент, по измеренной ЭДС которого возможно определить парциальное давление азота в азот-водородной газовой смеси, находящейся под давлением Р. Запишите уравнение Нернста для используемого гальванического элемента, назовите все входящие в него величины.
|
из
5.00
|
Обсуждение в статье: Химические цепи без переноса (приведите пример). Зависимость ЭДС |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

