 |
Главная |
Методы определения эквивалентной электрической проводимости растворов слабых и сильных электролитов при бесконечном разведении.
|
из
5.00
|
При повышении разведения эквивалентная электропроводность увеличивается. В случае сильных электролитов для сильно разбавленных растворов при снижении концентрации изменение эквивалентной электропроводности становится настолько малым, что им можно пренебречь и считать


Скорость движения и подвижность иона. Влияние природы иона и природы растворителя на подвижность иона. Связь предельной эквивалентной электрической проводимости иона с его подвижностью.
В отсутствии внешнего электрического поля ионы в растворе находятся в тепловом движении, совершая равновероятные во всех направлениях “перескоки” из одного квазиравновесного состояния в другое. При наложении электрического поля одно из направлений (вдоль силовой линии эл.поля) становится преимущественным. Величина перемещения иона в этом направлении за единицу времени определят предельную скорость движения иона, которая может быть рассчитана по уравнению:
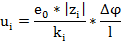
Скорость движения иона зависит от зарядового числа иона ( 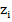 ), коэфицента трения (
), коэфицента трения (  ) и напряженности эл.поля (
) и напряженности эл.поля ( 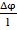 ).
).
Скорость движения иона при единичном градиенте электрического потенциала (1 В/м) называют электрической подвижностью иона. Электрическая подвижность иона (u) зависит от его заряда и вязкости среды.
Рассмотрим основные факторы, влияющие на подвижность иона в водных растворах при наличии электрического поля.

Заряд и радиус иона,т. е. его природа. Влияние этих характеристик иона взаимосвязано, но неоднозначно: чем больше заряд и чем меньше радиус иона, тем сильнее гидратируется ион, тем толще его гидратная оболочка и, следовательно, тем ниже подвижность иона в растворе. В соответствии с этим в ряду однозарядных ионов Li+, Na+, К+, Rb+, Cs+, который характеризуется последовательным возрастанием ионного радиуса, радиус гидратированного иона, наоборот, уменьшается, а определенная опытным путем электрическая подвижность ионов возрастает от Li+ к Cs+:
Отсутствие резких различий в подвижности многозарядных и однозарядных ионов также объясняется большей гидратацией многозарядных ионов, что увеличивает размер и снижает их подвижность в электрическом поле несмотря на больший заряд.
Природа растворителя,его диэлектрическая проницаемость и вязкость. Чем полярнее растворитель, тем лучше сольватируется ион, тем больше размеры гидратированного иона и, следовательно, меньше его подвижность. Вязкость растворителя обуславливает сопротивление среды движущемуся иону: чем больше вязкость, тем меньше подвижность иона.
Температура раствора.При повышении температуры уменьшаются вязкость растворителя и толщина сольватных оболочек ионов, а также снижается межионное взаимодействие. Все это приводит к увеличению подвижности ионов.
Ионная сила раствора.Чем больше ионная сила раствора, тем сильнее межионное электростатическое взаимодействие и создаваемые им тормозящие эффекты.
Концентрация ионов.Чем больше концентрация ионов в растворе, тем сильнее электростатическое взаимодействие ионов, снижающее их подвижность. Концентрация ионов зависит от силы электролита иего количества в растворе. При разбавлении растворов сильных электролитов подвижность соответствующих ионов растет, поскольку уменьшается их концентрация, а следовательно, снижается межионное взаимодействие в растворе. В растворах слабых электролитов (обычно а < 0,03) подвижность ионов практически не зависит от разбавления, так как концентрация ионов в этих растворах всегда невелика. 

34. Зависимость скорости движения и подвижности иона от его заряда и размеров (радиуса). Кристаллографический радиус иона Li+ меньше, чем иона K+. Какой из ионов дает больший вклад в электропроводность водных растворов хлоридов солей этих металлов при бесконечном разведении при одной и той же температуре? Для обоснования ответа приведите уравнения, связывающие между собой названные величины. (возможно указание и других ионов)
Природа иона определяется его радиусом r и зарядом z. Эти 2 фактора характеризуют поляризующую способность ионов по отношению к растворителю. В р-рах скорость движ.ионов определяется размерами сальват-ых ионов. Чем меньше радиус иона и больше заряд, тем большим поляризующим действием ион обладает.
Чем меньше кристаллограф.радиус, тем более сильное поле создает ион и тем в большей степени он гидратирован. Поэтому радиус гидр.иона Li больше, чем гидр.и.Na. К больше,чем Li.Однако, если собств.размер иона возрастает настолько,что прочная гидратная оболочка вокруг него уже не удерживается, то при дальнейшем увеличении кристиллограф. радиуса следует ожидать уменьшения подвижности. Эта закономерность наблюд-ся у катионов(при переходе от Cs к [(CH3)4N], и анионов(от Br к I и далее к CH3COO)
35. Числа переноса и подвижности ионов в растворе электролита, их связь с электрической проводимостью ионов. Сравните предельные числа переноса катиона и аниона в водном растворе … (дан конкретный бинарный электролит). Эстафетный механизм переноса электрического тока ионами гидроксония и гидроксила.
Числом переноса иона называют долю, которую составляет плотность тока, переносимого ионами данного вида, от общей плотности тока в растворе электролита.
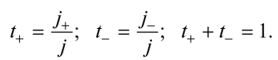 Для одного бинарного электролита в растворе:
Для одного бинарного электролита в растворе:
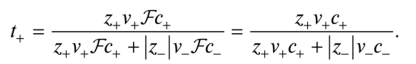 Число переноса можно связать с другими величинами.
Число переноса можно связать с другими величинами.
По условию электрической нейтральности 1+с+ = z-c_. Поэтому эти произведения в дроби сокращаются и остаются только скорости дрейфа ионов. Поскольку они связаны с подвижностями по (11.12), а подвижности связаны с ионными проводимостями по (11.17), получается следующее:
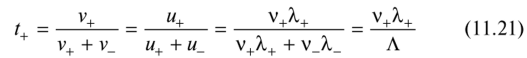


Благодаря этим соотношениям можно вычислять ионные проводимости из молярной проводимости электролита:
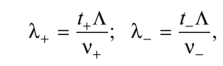

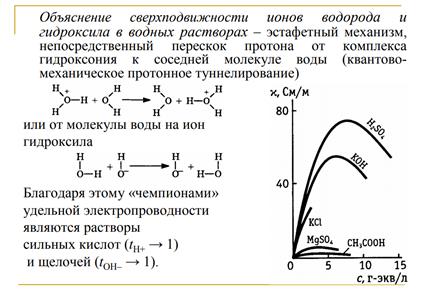
Ион водорода в водных растворах существует в виде иона гидроксония H3O+ , который дополнительно гидратируется 3 – 4 молекулами воды с образованием, например, комплекса H9O4 + . Подвижность ионов водорода и гидроксила в водных растворах многократно превышает подвижность всех остальных ионов. 
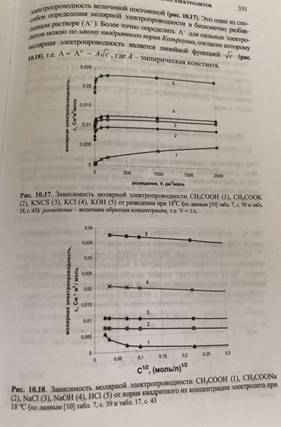
36. Как по данным об электрической проводимости растворов сильных электролитов определить эквивалентную электрическую проводимость при бесконечном разведении для раствора слабого электролита в том же растворителе? Какой закон лежит в основе метода определения? Проиллюстрируйте процедуру расчета каким-либо произвольным примером 
В основе лежит закон независимости движения ионов Кальрауша.
Растворы сильных электролитов. Основные положения теории Дебая-Хюккеля. Зависимость среднего ионного коэффициента активности от ионной силы раствора в разбавленных и концентрированных растворах сильных электролитов.
Растворы электролитов – вещества, которые в расплавленном или растворенном виде проводят электрический ток за счет движения ионов. Сильные электролиты — химические соединения, молекулы которых в разбавленных растворах практически полностью диссоциированны на ионы. Степень диссоциации таких электролитов близка к 1. К сильным электролитам относятся многие неорганические соли, некоторые неорганические кислоты и основания в водных растворах, а также в растворителях, обладающих высокой диссоциирующей способностью (спирты, амиды и др.).
· Сильные электролиты диссоциируют нацело
· Отклонение от идеальности связаны исключительно с электростатическими взаимодействиями
· Ионы рассматриваются, как материальные заряженные точки
· Взаимодействие между ионами заменяется на взаимодействие между ином и ионной атмосферой
Ионная атмосфера – вероятностное, статистическое, динамическое, постоянно меняющееся распределение ионов обоих знаков вокруг центрального иона с преимущественным нахождением ионов противоположного знака. Реальную ионную атмосферу заменяют на условную для упрощения расчетов.
Средний ионный коэф. активности является функцией зарядовых чисел и концентрации данного электролита и других, находящихся в растворе. Суммарное влияние всех электролитов в растворе на коэф активности любого из них определяется ионной силой.
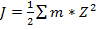
Средний ионный коэф не зависит от природы электролита в рамках данного валентного типа.
I приближение закона Дебая-Хюккеля справедливо для сильно разбавленных растворов с ионной силой до 0,01 моль/кг. 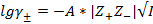 , где I – ионная сила раствора. – предельный закон.
, где I – ионная сила раствора. – предельный закон.
II Приближение теории Дебая-Хюккеля: справедливо для I раствора до 0,1 моль/кг. При этом учитываются размеры ионов.
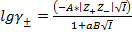 , где aB для водных растворов ~1.
, где aB для водных растворов ~1.
III Приближение теории Дебая-Хюккеля: справедливо для растворов электролитов с ионной силой до 1 моль/кг; учитывает сольватацию иона молекулами растворителя.
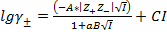 , где С – эмпирический параметр.
, где С – эмпирический параметр.
|
из
5.00
|
Обсуждение в статье: Методы определения эквивалентной электрической проводимости растворов слабых и сильных электролитов при бесконечном разведении. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

