 |
Главная |
Влияние посторонних электролитов на средний ионный коэффициент активности данного сильного электролита. Правило ионной силы раствора Льюиса-Рендала, область его применимости.
|
из
5.00
|

Ионная сила раствора. Правило ионной силы (или закон ионной силы Льюиса и Рендалла).
Концентрацию растворов сильных электролитов можно характеризовать не только активностью а, но и ионной силой. Активность а характеризует концентрацию одного электролита в растворе, а через ионную силу можно выражать концентрацию как одного, так и нескольких электролитов. Таким образом, ионная сила показывает суммарную концентрацию всех электролитов в растворе с учетом взаимодействия между ионами.
Ионная сила раствора (I, размерность концентрации) – это полусумма произведений концентраций всех ионов в растворе на квадрат их заряда.
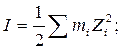
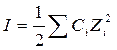
где 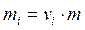 - моляльность i-го иона; m – моляльность электролита; Zi – заряд i-го иона.
- моляльность i-го иона; m – моляльность электролита; Zi – заряд i-го иона.
Пример: раствор содержит 0,001 моль H2SO4 и 0,002 моль MgSO4на 1000 грамм H2O. Какова ионная сила раствора?
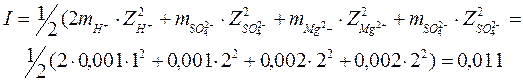
От ионной силы раствора зависит γ±. Эта зависимость выражается правилом ионной силы (или закон ионной силы Льюиса и Рендалла):
коэффициенты активности ионов не зависят от конкретного вида ионов, находящихся в растворе, а зависят от ионной силы I раствора.
Это эмпирическое правило строго выполняется при концентрациях до 0,01 моль/кг и приближенно до 0,1 моль/кг (рис. 2).
В области концентраций 0,01 – 0,1 моль/кг существуют следующие закономерности:
1.зависимость 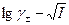 линейная, поэтому γ± зависит только от I и не зависит от природы иона;
линейная, поэтому γ± зависит только от I и не зависит от природы иона;
2. для соединений одного валентного типа γ± одинаков (т. к. в области низких концентраций тангенс угла наклона прямой одинаков).
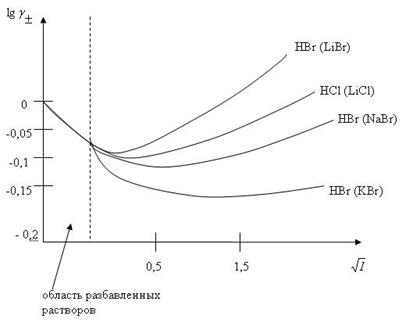
Рис. 2. Средние коэффициенты активности HCl и HBr в растворах галогенидов щелочных металлов при 25 0С.
Теория сильных электролитов Дебая-Хюккелясправедлива только для разбавленных растворов сильных электролитов.
Основные положения теории:
1. собственными размерами ионов можно пренебречь по сравнению с расстоянием между ними, поскольку растворы разбавленные.
2. учитываются только кулоновские взаимодействия между ионами и не учитываются другие виды взаимодействия (ион-дипольное, образование ассоциатов за счет водородной связи и т. д.)
3. электростатическое взаимодействие между ионами рассматривается как взаимодействие между центральным ионом и его ионной атмосферой.
4. вследствие кулоновского взаимодействия ионы в растворе расположены упорядочено, а растворы являются неидеальными.
48. Возникновение скачка потенциала на границе раздела проводников I и II рода. Обратимые электроды и обратимые гальванические элементы. Условная запись правильно разомкнутого гальванического элемента. Электродвижущая сила (ЭДС) гальванического элемента.
Процесс возникновения скачка потенциала на границе раздела двух фаз.
Структура металла – система плотно упакованных сфер одинакового радиуса – положительных ионов. Атомы металла располагаются в кристаллической решетке на таком расстоянии, что их валентные электроны фактически связаны не с отдельным ядром, а делокализованы (обобщены) по всем атомам. Суммарный положительный заряд равен числу электронов и в обычном состоянии металл электронейтрален.
Растворение металла – переход катионов в раствор с поверхности электрода (пластинки металла) объясняется гидратацией катионов (Рис.4.). Катионы поверхности металла взаимодействуют с диполями воды. Возрастающая при этом теплота гидратации идет на разрыв связи ионов с кристаллической решеткой металла. Способность металла переходитьв раствор выражается тем сильнее, чем меньше потенциал ионизации и чем выше его  .
.
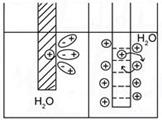
Обратный процесс – осаждение катионов металла из раствора на поверхность электрода. Процессы перехода катионов металлов в раствор (окисление) и осаждение (восстановление) идут одновременно. Через определенный промежуток времени наступает динамическое равновесие на границе раздела твердой и жидкой фаз.
Ионы из-за электростатического взаимодействия с противоположно заряженной поверхностью электрода ориентируются вблизи поверхности раздела фаз. Образуется двойной электрический слой (ДЭС) .
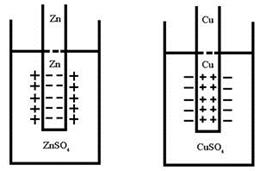
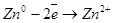
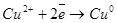
Гальванические элементы – химические источники электрического тока, позволяют получить работу за счет протекания химической реакции. Если из нескольких проводников (металлов растворов электролитов) составить цепь, то между концами такой правильно разомкнутой цепи возникает разность потенциалов Е ( ЭДС ), численно равная сумме всех скачков потенциалов на границах раздела фаз: 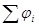 . ЭДС – разность потенциалов на концах разомкнутой цепи, когда во внешней цепи сила тока равна нулю.
. ЭДС – разность потенциалов на концах разомкнутой цепи, когда во внешней цепи сила тока равна нулю.
Гальванический элемент производит работу за счет окислительно-восстановительной реакции и поэтому его ЭДС, которая численно равна максимальной работе по перемещению заряда по замкнутой цепи, должна быть больше нуля. Из:
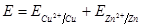
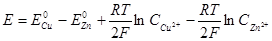
Обратимыми гальваническими элементами называются такие элементы, в которых при пропускании тока в противоположном направлении происходят обратные химические реакции. Если сила тока мала и джоулевым теплом можно пренебречь, то прохождение тока через такой элемент можно рассматривать как обратимый процесс.
Обратимым электродом называют такой, у которого в месте соприкосновения электрода с электролитом, при перемене направления тока, совершается химическое прекращение, как раз обратное тому, что совершалось при первоначальном направлении тока.
Для гальванического элемента принята следующая форма записи (на примере элемента Даниэля):
Zn | ZnSO4 || CuSO4 | Cu,
где вертикальная линия | обозначает границу раздела фаз, а двойная вертикальная линия || - солевой мостик. Электрод, на котором происходит окисление, называется анодом; электрод, на котором происходит восстановление, называется катодом. Гальванический элемент принято записывать так, чтобы анод находился слева.
Электродные полуреакции принято записывать как реакции восстановления (таблица 12.1), поэтому общая реакция в гальваническом элементе записывается как разность между реакциями на правом и левом электродах:
Правый электрод: Cu2+ + 2e = Cu
Левый электрод: Zn2+ + 2e = Zn
Общая реакция: Cu2+ + Zn = Cu + Zn2+
Приведите пример химического гальванического элемента, составленного из газового электрода и электрода второго рода, электрохимическая цепь без жидкостных соединений – «без переноса». Запишите уравнения электродных полуреакций и уравнение химической реакции, за счет энергии которой вырабатывается электрическая энергия данным элементом.

Газовые электроды, водородный электрод. Вывод и анализ уравнения, выражающего зависимость потенциала водородного электрода от активности водородных ионов и давления молекулярного водорода.
Рис. 8. Водородный электрод.
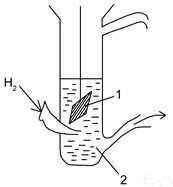 1 – платинированная платина
1 – платинированная платина
2 – концентрированная серная кислота, омывается потоком водорода
Три состояния водорода:
а) молекулярный водород;
б) 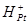 - молекулы водорода адсорбированные на поверхности платины;
- молекулы водорода адсорбированные на поверхности платины;
в) 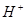 - ионы в растворе. Электродные реакции:
- ионы в растворе. Электродные реакции:
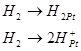
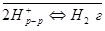
Суммарная реакция является каталитической и протекает на поверхности платины.
По уравнению Нернста:
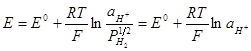 ,
,
где 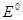 - стандартный потенциал водородного электрода (нормальный).
- стандартный потенциал водородного электрода (нормальный).
При всех температурах, 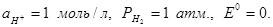
Электродный потенциал любого другого электрода можно определить как ЭДС гальванического элемента, составленного из исследуемого электрода и стандартного водородного. Водородный электрод обозначается в схеме слева.
Газовый электрод представляет собой полуэлемент, состоящий из металлического проводника, контактирующего одновременно с соответствующим газом и с раствором, содержащим ионы этого газа. Конструирование газового электрода невозможно без участия проводника с электронной проводимостью. Требования к металлу в газовых электродах : 1) должен ускорять медленно устанавливающееся электродное равновесие, т.е. служить катализатором электродной реакции; 2) потенциал металла в газовом электроде не должен зависеть от активности других ионов раствора, в частности от активности собственных ионов металла; 3) должен быть инертным по отношению к другим возможным реакциям; 4) должен обеспечивать создание максимально развитой поверхности раздела между фазами, на которой могла бы протекать обратимая реакция ионизации газа. Всем этим требованиям лучше всего удовлетворяет платина, электролитически покрытая платиновой чернью (платинированная платина). Газовые электроды очень чувствительны к изменению состояния поверхности платины, особенно к отравлению ее каталитическими ядами.
Водородный электрод. Условная шкала потенциалов. Уравнение Нернста для потенциала водородного электрода. Зависимость потенциала электрода от рН раствора и давления молекулярного водорода.
Водородный электрод состоит из платиновой пластинки, покрытой высокодисперсной платиной для создания развитой активной поверхности и адсорбции достаточного количества водорода. Эта пластинка частично погружена в раствор, содержащий ионы водорода. Через раствор пропускают чистый водород под постоянным давлением. Молекулы водорода адсорбируются на поверхности платины, распадаясь при ее каталитическом действии на атомы, и адсорбированные атомы участвуют в электродном процессе.
Записывается водородный электрод в виде: Н+| H 2| Pt 



Стандартный водородный электрод. Условный электродный потенциал (потенциал электрода в водородной шкале). Связь ЭДС гальванического элемента с условными электродными потенциалами. Правило знаков ЭДС и электродных потенциалов.



|
из
5.00
|

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

