 |
Главная |
Сульфаны (полисульфиды водорода)
|
из
5.00
|
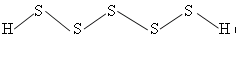
Т. к. связь S−S прочна, то существуют полисульфиды водорода (сульфаны) H2S2, H2S3, H2S4 и т. д. В воде проявляют свойства более сильных кислот, чем H2S, поэтому гидролизуются меньше. А их соли полисульфиды используются, как пестициды.
H 2 SX X =1÷8
Na 2 S + S = Na 2 S 2
Na 2 S +2 S = Na 2 S 3
Они имеют зигзагообразные цепи. Сульфаны – это жёлтые, вязкие жидкости с резким запахом, растворимые в растворах щелочей с образованием поли-сульфидовщёлочных металлов.


Диоксид серы (сернистый газ) SO2 – бесцветный газ, с резким запахом, хорошо растворим в воде, менее токсичен , чем сероводород. Водный раствор называется сернистой кислотой, которая не существует в свободном виде.
SO2 + H2O ↔ H++HSO - 3 ↔ 2H++SO32-
К1 = 2∙10-2 ; К2 = 6∙10-8.
Кислота средней силы.Образует средние соли сульфиты, кислые – гидросульфиты.
При нагревании сульфиты диспропорционируют:

SO 2 сернистый газ, ангидрид сернистой кислоты (H2SO3). Один из основных источников загрязнения атмосферы, менее токсичен, чем H2S.
SO 2 – бесцветный газ с резким запахом.
|
При сгорании серы S + O 2 → SO 2 ↑
при сгорании H2S 2H2S + 3O2 → 2SO2↑ + 2H2O
при взаимодействии металлов с конц. H2SO4 :
Cu + 2H2SO4 k онц = CuSO4 + SO2↑ + 2H2O
при обжиге сульфидов 2CuS + 3O2 = 2CuO + 2SO2↑
или дисульфида железа 4 FeS 2 + 11 O 2 = 2 Fe 2 O 3 + 8 SO 2 ↑
Химические свойства SO2
1) Реакции без изменения степени окисления (типичный кислотный оксид)
SO2 + Ca(OH)2 → CaSO3 +H2O
SO2 + 2NaOH → Na2SO3 + H2O
SO2 + NaOH → NaHSO3
Na2SO3 + SO2 + H2O → 2 NaHSO3
2) реакции с понижением степени окисления
SO 2 + 2 H 2 S → 3 S ↓ + H 2 O
3) реакции с повышением степени окисления
+4 +6
Na 2 SO 3 + Cl 2 + H 2 O → Na 2 SO 4 + 2 HCl
В ряду соединений серы H 2 S -2 , S 0 8 , S +4 O 2 , S +6 O 3 - если сера в промежуточной степени окисления, то обладает окислительно-восстановительной двойственностью.
SO2 - окислитель:
SO2 + H2S → S + H2O
SO2 + C → S + CO2↑
SO2 + 2CO → S + 2CO2↑
SO2 – восстановитель:
400-500, v2o5
2 SO 2 + O 2 ↔ 2 SO 3
SO 2 + Br 2 + H 2 O → H 2 SO 4 + 2 HBr
SO 2 + HNO 3 K онц → H 2 SO 4 + 2 NO 2 ↑
Pb +4 O 2 + SO 2 → Pb +2 SO 4
SO2 – ангидрид сернистой кислоты, при растворении (40 V в 1 V H2O), образует неустойчивую сернистую кислоту H 2 SO 3
SO 2 +Н2О ↔ H 2 SO 3
H2O + SO2 ↔ H2SO3 ↔ H+ + HSO4- ↔ 2H+ + SO32-
К1=1,6∙10-2 К2=6,1∙10-8
H2SO3 в свободном виде не выделена, также как SO2 обладает двойственностью, её растворы при нагревании окисляются.
2H2SO3 + О 2 → 2H2SO4
H2SO3 + Br2 + H2O → H2SO4 + 2HBr
H2SO3 + 2H2S → 3S↓ + H2O
Соли получают:
1) KOH + SO2 → KHSO3
2KOH + SO2 → K2SO3 + H2O
2) CaCl 2 + Na 2 SO 3 → CaSO 3 ↓ + NaCl
3) Пропусканием SO2 в растворы солей более слабых кислот
Na 2 С O 3 + SO 2 → Na 2 SO 3 + CO 2 ↑
средние в кислые
Na 2 SO 3 + SO 2 + Н2О → 2 NaHSO 3
Кислые в средние
NaHSO 3 + NaOH → Na 2 SO 3 + H 2 O
Сульфиты и гидросульфиты разлагаются сильными кислотами
t
NaHSO3 + HCl → NaCl + H2O + SO2↑
t
K2SO3 + H2SO4 → K2SO4 + H2O + SO2↑
2Na2SO3 + O2 → 2Na2SO4
Сульфиты диспропорционируют 4K2SO3 → K2S + 3K2SO4
Na2SO3 + S → Na2S2O3 – тиосульфат.
Подвергаются гидролизу
SO32- + HOH ↔ HSO - 3 + OH-
К 2 SO3 + HOH ↔ К HSO3 + К OH
Триоксид серы (серный ангидрид) SO 3
SO3 – ангидрид H2SO4. Бесцветная жидкость при
160С < t <42ºC, затвердевает при t < 160С, в газовой фазе при t > 42ºC, tкип = +45ºС, ядовит, молекула имеет sp2 гибридизацию, форму плоского треугольника, угол между связями - 120º.

В технике SO3 получают окислением SO2 в присутствии катализатора (Pt, оксиды ванадия)
Pt
2 SO 2 + O 2 = 2 SO 3 – ангидрид серной кислоты
SO 3 + H 2 O = H 2 SO 4
В водных растворах H2SO4 – сильная двухосновная кислота. Гидратация H2SO4 сопровождается выделением большого количества теплоты за счёт образования гидратов:
H2SO4 ∙ H2O
H2SO4 ∙ 2H2O
H2SO4 ∙ 4H2O
Поэтому смешивать H2SO4 c водой следует очень осторожно.
В виде SO3 только в газовой фазе, хорошо полимеризуется в жидком состоянии циклический триммер, в кристаллические – зигзагообразные цепи. Термически нестоек при t>700º разлагается:
>7000С
2 SO 3 ↔ 2 SO 2 + O 2
SO3 –типичный кислотный оксид, бурно реагирует с водой (Н2О)
SO3( кр ) + H2O ж → H2SO4 ж
SO3 + Ba(OH)2 → BaSO4↓ + H2O
SO3 + CaO → CaSO4
SO3 + NaOHP → NaHSO4
SO3 + 2NaOHK → Na2SO4 + H2O
S+6 (высшая) – поэтому сильнейший окислитель
5 SO 3 + 2 P → P 2 O 5 + 5 SO 2 ↑
3 SO 3 + H 2 S → 4 SO 2 ↑ + H 2 O
SO3 растворяется в безводной H2SO4 образуя олеум. Вливают серную кислоту тонкой струйкой в воду, а не наоборот.
Концентрированная H2SO4 поглощает пары воды, поэтому её применяют в качестве осушителя; она отнимает воду и от органических веществ обугливая их. Полиамиды (капрон, нейлон), шёлк быстро разрушаются ею, шерсть более устойчива к её действию.
Получение H 2 SO 4
1) константный способ. катализатор – Pt, кислота получается любой концентрации. SO2 поглощается H2SO4 получается олеум. Конценрацию (98%) получают смешиванием олеума с разбавленной H2SO4.
Схема получения:
O2 O2 H2O
FeS2 → SO2 → SO3 → H2SO4
катализ
2) нитрозный способ: катализатор – оксиды азота. Конечный продукт содержит 78% H2SO4
2 NO + O 2 → 2 NO 2
SO2 + NO2 + H2O → H2SO4 + NO
Химические свойства H2SO4
Концентрированная H2SO4 (ω=93 – 98%) более сильный окислитель (особенно при нагревании), окисляет даже металлы после Н2; не окисляет Fe(только при нагревании), Au, Pt- новые металлы.
В зависимости от концентрации:
t
( Ag , Cu ) Zn + H 2 SO 4 K → ZnSO 4 + SO 2 ↑ + H 2 O
3Zn + 4H2SO4 → 3ZnSO4 + S↓ + 4H2O
ω =50%
4Zn + 5H2SO4 → 4ZnSO4 + H2S↑ + 4H2O
Конц. H2SO4 окисляет неметаллы:
t
2P + H2SO4 → 2H3PO4 + 5SO2↑ + 2H2O
t
S + 2H2SO4 → 3SO2↑ + 2H2O
При комнатной t HI, HBr, H2S
8HI +H2SO4 → 4I2 + H2S↑ + 4H2O
H2S + H2SO4 → S + SO2↑ + 2H2O
Разбавленная обладает всеми типичными свойствами кислот:
1) Изменяет окраску индикаторов.
2) Реакции с:
Oсновными оксидами CaO + H2SO4 = CaSO4 + H2O
Амфотерными оксидами ZnO + H2SO4 = ZnSO4 + H2O
Щёлочами KOH + H 2 SO 4 = K 2 SO 4 + H 2 O
Нерастворимыми основаниями
Cu(OH)2 + H2SO4 = CuSO4 + 2H2O
Солями K2 С O3 + H2SO4 = K2SO4 + СО 2 + H2O
K2SiO3 + H2SO4 = K2SO4 + H2SiO3↓
С аммиаком 2NH3 + H2SO4 = (NH4)2SO4
И его водными растворами NH 3 ∙Н2О + H 2 SO 4 = NH 4 Н SO 4 + Н2О
При взаимодействии с Ме в РСЭП до Н2 разб. H2SO4 обладает окислительными свойствами за счёт ионов Н+
Fe + H 2 SO 4 p → FeSO 4 + H 2
(у металлов реализуется низшая степень окисления).
Важное свойство её нелетучесть, поэтому используют для получения летучих кислот путём вытеснения из сухих (крист).
KCl кр. + H 2 SO 4 K → KHSO 4 + HCl ↑
Безводная H2SO4 – вязкая маслянистая жидкость, требует осторожного обращения во избежание разбрызгивания вливать надо H2SO4 в воду, а не наоборот.
Тиосоединения. При замене в сульфат-ионе одного атома кислорода на атом серы образуются тиосульфат –ионы S2O32-.
В лаборатории тиосульфаты получают при кипячении раствора сульфита с порошком серы.
Na2S+4O3 + S0 = Na2S2+6/ -2O3

Тиосерная кислота неустойчива из-за протекания внутримолекулярного окислительно-восстановительного процесса. Поэтому при подкислении тиосульфатов они начинают выделять свободную серу и SO2.

Сильные кислоты вытесняют из тиосульфатов тиосерную кислоту:
Na2S2O3 + 2HCl = H2S2O3 + 2NaCl =H2O + SO2↑+ S↓
Na2S2O3 + 2HCl → 2NaCl + SO2↑ + S↓ +H2O
Наличие в тиосульфатах S-2 придаёт им восстановительные свойства.
В фотографии кристаллогидрат Na2S2O3∙5H2O (под названием гипосульфит) является основным компонентом для приготовления закрепляющих растворов, т.к. образует с ионами Ag+ прочные комплексы [Ag+(S2O3)2]3-, удаляет из фотоэмульсии неизрасходованные галогениды серебра.
Пиросульфаты – соли пиросерной кислоты (двусерной), H 2 S +6 2 O 7.
Это смесь SO3 и H2SO4, так называемый олеум (смесь полисерных кислот), состав можно представить H 2 SO 4 ∙ xSO 3.


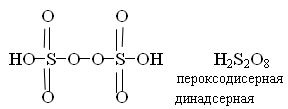
Пероксосульфаты H + 2 SO -2 5 (пероксомоносерная)
(мононадсерная)

Применение солей
Na 2 SO 4 ∙ 10 H 2 O – глауберова соль (в производстве соды, стекла)
2 CaSO 4 ∙ H 2 O – алебастр (лепка, шины при переломах)
MgSO 4 ∙ 7 H 2 O – (горькая соль) в медицине слабительное.
CuSO 4 ∙ 5 H 2 O – для борьбы с вредителями сельского хозяйства.
FeSO 4 ∙ 7 H 2 O – для очистки воды, консервирования (предохранение древесины от гниения)
BaSO 4 – медицине рентгеноконтрастное вещество.
ZnSO 4 ∙ 7 H 2 O – цинковый купорос – протрава при крашении тканей.

Биогенная роль
Кислород – самый распространенный и самый активный и химически подвижный элемент земной коры. Кислород входит в состав свыше 1200 минералов. Господствуют среди них соли кислородных кислот и оксиды. Кислород образует соединения со всеми химическими элементами (кроме благородных газов) и с большинством из них реагирует непосредственно.
ОН-- составная часть воды – составляет 70% живого вещества.
Кислород входит практически во все жизненно важные молекулы. Исключительно велика его роль в процессах фотосинтеза. Выделяясь при фотосинтезе, он поступает в атмосферу.
С содержанием кислорода в воздухе, воде и почве связаны многие жизненные процессы. Например «горная болезнь» вызывается недостатком кислорода в высокогорных условиях.
Из рыб наименее требователен к содержанию кислорода карась, который спокойно живёт в заросших прудах, где почти весь кислород расходуется на окисление органических веществ. В то же время карп очень требователен в этом отношении. Ещё больше кислорода требуют форель и другиевиды рыб горных рек и водоёмов.
Ежегодно в мире сжигается 7-8 млрд. т. органического топлива, на что расходуется около 10-12 млрд.т. свободного кислорода атмосферы. Только один реактивный лайнер при перелете из Америки в Европу за 8 часов расходует 70-75т. кислорода. Примерно такое количество кислорода могут произвести за тоже время 25-50 тыс. га леса. Но советский географ Давитал подсчитал, что даже при 5% ежегодного прироста сжигаемого топлива уже примерно через 150-180 лет содержание кислорода в атмосфере может снизится до критического для человека предела.
Уменьшение парциального давления на 1/3 вызывает кислородное голодание, а на 2/3 – смертельный исход.
Сера – важнейший биофильный элемент, активно захватывается живым веществом, входит в состав белков и других соединений. Сера – относительно распространенный химический элемент. Содержание в земной коре равен 5·10-2 %. В различных количествах сера входит в состав всех растительных и животных организмов. Особенно её много в белках. Её можно назвать «связывающим веществом» белка, поскольку главной функцией серы является обеспечение полипептидных связей в молекуле белка. Сульфидная сера содержится в крови многих позвоночных животных. Она – важный компонент многих биологически активных веществ (например, витаминов), гормонов инсулина и катализатора глютатиона. В животных организмах сера обнаружена в нервных тканях, в хрящах и костях, в желчи. Животные усваивают этот элемент в основном в виде аминокислот, но всасываться из пищеварительного тракта могут и неорганические соединения (сульфаты, сероводород и т. д. )
Все органические соединения серы – суфамидные препараты: сульфидин, сульфазол, сульгин, сульфодимизин, стрептоцид и др. подавляют активность многочисленных микробов. Многие антибиотики также содержат в своём составе серу.
SO2 и H2SO3 обесцвечивают многие красители, образуя бесцветные соединения, которые могут снова разлагается при нагревании или на свету, в результате чего окраска восстанавливается. Следовательно, белящее действие их отличается от белящего действия хлора. Обычно SO2 белят шерсть, шёлк, солому. SO2 убивает многие микроорганизмы. Поэтому для уничтожения плесневых грибков им окуривают сырые подвалы, погреба, винные бочки и др.Используют при перевозке и хранении фруктов и ягод.
Ca ( HSO 3 )2 – сульфитный щелок – обрабатывают древесину и бумажную массу.

Серный цвет – коллоиднодисперсная сера – используется как инсектицид и фунгицид.
Важнейшее для сельского хозяйства соединение H2SO4 в огромных количествах расходуется для производства фосфорных удобрений.
Серу используют в медицине, сельском хозяйстве как в свободном так и связанном виде. Молотую серу используют для опыливания растений против вредителей. SO2 окуривают зернохранилища. Растения усваивают её из растворимых в воде сульфатов. В ветеринарии серные мази используют для лечения кожных заболеваний. Идёт на изготовление спичек.
В производстве резины серу (или её соединения) используют для вулканизации каучука, т. е. поперечного «сшивания» его макромолекул. При введении в каучук максимального количества серы в результате вулканизации получается эбонит - жёсткий материал, обладающий электроизоляционными свойствами. Сера используется при изготовления чёрного пороха, сероуглерода, H2SO4.
Селен используют для изготовления выпрямителей и фотоэлементов. Многие селениды и теллуриды применяют как полупроводники. Добавка селена к стеклу и эмали окрашивает их в красный цвет.
ЛЕКЦИЯ 7
|
из
5.00
|
Обсуждение в статье: Сульфаны (полисульфиды водорода) |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

