 |
Главная |
КРИТИЧЕСКИЕ ЯВЛЕНИЯ В ДВОЙНЫХ СМЕСЯХ
|
из
5.00
|
ФЕДЕРАЛЬНОЕ АГЕНСТВО ПО ОБРАЗОВАНИЮ
ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«БАШКИРСКИЙ ГОСУДАРСТВЕННЫЙ ПЕДАГОГИЧЕСКИЙ УНИВЕРСИТЕТ им. М. АКМУЛЛЫ»
(ГОУ ВПО «БГПУ им. М. АКМУЛЛЫ»)
Факультет физико-математический
Кафедра общей физики
Специальность физика
Курс IV
ОСОБЕННОСТИ ФАЗОВЫХ ПРЕВРАЩЕНИЙ В БИНАРНЫХ СМЕСЯХ
КУРСОВАЯ РАБОТА
Научный руководитель д.ф.-м.н., профессор
.
Уфа 2007
СОДЕРЖАНИЕ
Введение
1. Критические явления в двойных смесях
1.1. Критические явления при испарении двойных смесей
1.2. Критические явления растворения в двойных смесях
1.3. Критические явления и устойчивость по отношению к диффузии
1.4. Геометрическая интерпретация условия устойчивости по отношению к диффузии
2. Связь между условиями механической устойчивости и устойчивости по отношению к диффузии в двойных системах
3. Расслаивание в регулярных растворах
4. Фазовые переходы смачивания и предсмачивания в бинарной системе (метанол-гептан)
5. Взаимная растворимость в твердом состоянии
Приложение
Литература
ВВЕДЕНИЕ
Важно, представлять, что проблема фазовых переходов не зависит от существования уравнения состояния, общего для обеих фаз. Такого рода непрерывное уравнение неизвестно, например, для твердого тела и жидкости. Расчет условий сосуществования фаз, основывающийся на использовании общего для них уравнения состояния и применении теоремы Максвелла, необходимо рассматривать как искусственный прием, который может привести к правильным результатам, но не может быть обоснован при последовательном статистическом рассмотрении.
В действительности, при рассмотрении проблемы фазовых переходов, задача заключается в изучении мольной свободной энергии F /п. В области сосуществования двух фаз F / n является линейной функцией мольного объема, а давление остается постоянным. Термодинамика сама по себе не может ничего сказать ни о существовании таких областей, ни об их числе. Эта задача должна решаться методами статистической механики взаимодействующих систем, которые еще не вполне разработаны. Все же можно отметить, что фазовые переходы непосредственно связаны с числом геометрических измерений системы. Можно показать, что в одномерном случае, когда молекулы располагаются вдоль некоторой линии, фазовые переходы невозможны независимо от природы межмолекулярных сил. Термодинамические свойства непрерывно изменяются во всей области изменения температуры и «объема», которым в данном случае является длина фазы.
Общая формулировка условий, определяющих возникновение новой фазы, является важной проблемой теоретической физики, которая не нашла еще своего полного разрешения.
КРИТИЧЕСКИЕ ЯВЛЕНИЯ В ДВОЙНЫХ СМЕСЯХ
1.1. КРИТИЧЕСКИЕ ЯВЛЕНИЯ ПРИ ИСПАРЕНИИ ДВОЙНЫХ СМЕСЕЙ
Рассмотрим теперь подробно критические явления, происходящие при испарении двойной смеси. В этом случае удобно рассматривать T — р-диаграмму при постоянном составе (рис.1). При наличии одного чистого вещества получается просто кривая АС, оканчивающаяся в критической точке С. Когда речь идет о смеси постоянного состава, необходимо принять во внимание, что одной и той же температуре соответствуют два значения давления, одно из которых соответствует жидкости, а другое пару того же самого состава. Этим двум давлениям соответствуют две точки (Разумеется, жидкость и пар в этих состояниях не находятся в равновесии.) При повышении температуры мы получаем кривую FGKH на рис.1, левая ветвь которой от F до К соответствует жидкости, а правая ветвь КН — пару. Точка К является критической точкой, в которой обе фазы тождественны. Вблизи К расположены точка М, соответствующая температуре Т m и также точка L , соответствующая давлению рт. Нужно указать, что в некоторых системах положение точки К может отличаться от изображенного на рис.1: она может находиться не между L и М, но и левее L или ниже М. Установить это, конечно, можно только экспериментом, Критическое давление и критическая температура в случае двойной смеси имеют совершенно иной смысл, чем для чистого вещества. Так, максимальному давлению, при котором могут сосуществовать две фазы, соответствует точка L, а максимальной температурой, при которой возможно сосуществование двух фаз, является температура Тт вточке М.
| Рис.1. T – p-Диаграмма двойной Рис.2. Критическая кривая в смеси постоянного состава. системе СHСl3 — СO2. А — критическая точка чистого СHСl3, В — критическая точка чистой СО2. . |
|
|
|
|
 | |||
 | |||
В случае, изображенном на рис.1, выше критического давления имеется, следовательно, область давлении рс рт, в которой система может находиться в конденсированном состоянии, и, аналогично, имеется область температур Тс Т m , расположенная выше критической температуры, в которой может происходить конденсация. Для чистого вещества эти три точки L , К и М совпадают, но для двойной смеси эхо не является необходимым.
При рассмотрении рис.1 обнаруживаются еще две интересные особенности. Если повышать температуру системы при постоянном давлении p1, то первоначально система содержит только жидкость. При пересечении изобары и кривой жидкости в точке G начинается испарение. В общем случае изобара затем пересечет ветвь кривой, соответствующую пару, и это будет соответствовать моменту полного испарения. Однако в рассматриваемом нами частном случае изобара снова пересекает кривую жидкости в точке D , расположенной между L и К. Вэтой точке имевшийся ранее пар исчезает. Это явление называется ретроградным испарением. По ту сторону D система переходит из жидкого состояния в газообразное без разделения на две фазы. Подобным же образом, если сжимать пар при температуре Т1, при пересечении изотермы с кривой пара начинается конденсация. Однако изотерма еще раз пересекает кривую пара между точками М и К, и образовавшаяся было жидкость снова испаряется. Это явление называют ретроградной конденсацией.
Геометрическим местом критических точек, соответствующих последовательности смесей различного состава, является критическая кривая, изображенная на рис.2.
Помимо диаграммы Т—р при постоянном составе, полезно исследовать зависимость мольных объемов обеих фаз от состава при постоянной температуре. Если температура ниже любой из критических температур па критической кривой, диаграмма имеет вид, изображенный на рис.3.
Линия va г vb г соответствует мольным объемам паровой фазы, линия
va ж v в ж относится к жидкой фазе. Прямые va ж va г , q ж q т , …, соединяющие две фазы, находящиеся в равновесии, были названы Ван дер Ваальсом бинодалями.

Рис. 3. v—x-диаграмма двойной смеси ниже критической области (Т = const).
Рис.4. v—x-диаграмма двойной смеси в критической области (Т= const).
При температуре, лежащей между критическими температурами образующих смесь чистых компонентов, диаграмма v — xприобретает вид, изображенный на рис.4. Бинодали становятся все короче и короче и, наконец, исчезают в критической точке К. Кривая va г r г Kr ж va ж называемая кривой насыщения.
Нужно отметить, что на рис.3 и рис.4 представлены лишь примеры типичного поведения смесей, и возможны также многие другие формы кривых.
1.2. КРИТИЧЕСКИЕ ЯВЛЕНИЯ РАСТВОРЕНИЯ В ДВОЙНЫХ СМЕСЯХ
Помимо критических явлений при испарении, когда жидкая фаза становится тождественной газовой фазе, существуют также критические явления при растворении, при которых тождественными в критической точке становятся две жидкие или две твердые фазы, причем каждая из них является раствором.
Например, н-гексан и нитробензол при обычных давлениях смешиваются в любых отношениях при температурах, превышающих 19° С. Ниже этой температуры образуются две фазы, одна из которых обогащена гексаном, другая — нитробензолом. При 10° С мольные доли нитробензола и гексана в одной из фаз равны соответственно 0,18 и 0,82, а в другой — 0,70 и 0,30 (см. рис.5).

Рис.5. Фазовая диаграмма системы н-гексан — нитробензол при атмосферном давлении. x C 6 HsNO 2.
В точке С обе жидкие фазы становятся одинаковыми. Эта точка называется критической точкой растворения. При изменении общего давления критическая температура и состав критической смеси также изменяются и образуют критическую кривую растворения.
|
|
Повышение давления повышает критическую температуру растворения и вызывает уменьшение взаимной растворимости веществ. Мы уже видели ранее, что давление оказывает незначительное влияние на термодинамические свойства конденсированных фаз; и в рассматриваемом случае повышение давления на 250 атм также изменяет критическую температуру всего лишь на 1,6° С.
В приведенных выше примерах критическая температура является наивысшей температурой, при которой возможно сосуществование двух фаз; в таких случаях говорят о верхней критической температуре растворения.
Иногда наблюдается и другой тип поведения систем, соответствующий рис.6, на котором изображена фазовая диаграмма системы с нижней крити ческой температурой растворения. Ниже этой температуры система всегда образует одну устойчивую фазу. Примерами систем такого рода являются жидкая двуокись углерода — нитробензол, диэтиламин — вода и триэтиламин — вода.


Рис.6. Фазовая диаграмма системы диэтиламин — вода с нижней критической температурой растворения {р = const).
Рис.7. Фазовая диаграмма системы м-толуидин—глицерин с верхней и нижней критическими температурами растворения (р= 1 атм)
Наконец, существуют системы, обладающие как верхней, так и нижней критическими температурами -растворения. Примером является система м-толуидин — глицерин, фазовая диаграмма которой изображена на рис.7.
1.3 КРИТИЧЕСКИЕ ЯВЛЕНИЯ И УСТОЙЧИВОСТЬ ПО ОТНОШЕНИЮ К ДИФФУЗИИ
При исследовании критических явлений в однокомпонентных системах мы видели, что существенное значение при этом имеет условие механической устойчивости. Критическая точка, в сущности, отделяет области механически устойчивых состояний от метастабильных и неустойчивых областей.
В двойных системах необходимо, кроме того, принять во внимание условие устойчивости по отношению к процессам диффузии. Фактически здесь именно это условие определяет устойчивость системы. В пункте 2 выясним, почему условие механической устойчивости не имеет никакого значения при определении равновесия в двойной системе.
Условие равновесия по отношению к диффузии может быть записано в виде
µ12 = µ22 < 0,
что эквивалентно
 или
или  (1)
(1)
Эти условия можно проиллюстрировать на примере системы гексан — нитробензол, фазовая диаграмма которой была приведена на рис.5.

Рис.8. Изменение химического потенциала с составом при постоянных Т и р.
Если для ряда температур изобразить химический потенциал гексана как функцию мольной доли нитробензола при постоянном давлении, мы получим семейство кривых, схематически изображенное на рис.8. Выше 19° (кривая 1)имеется только одна фаза, и условия (1) всегда выполнены.
Напротив, пиже 19° кривая (например,
кривая 3)состоит из трех частей, а именно из участка, соответствующего слою, богатому нитробензолом, участка, относящегося к слою, богатому гексаном, и горизонтальной прямой, соединяющей эти участки и соответствующей одновременному наличию двух фаз.
Кривая при 19° С образует границу между этими двумя типами кривых. Горизонтальный отрезок на ней выродился в одну точку перегиба С, характеризуемую условиями

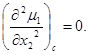 (2)
(2)
Критическое состояние устойчиво, так как

Действительно, если химический потенциал fit разложить в ряд в области, примыкающей к критической точке, то, пренебрегая членами высших порядков, получим
 (3)
(3)
Из рис.8 следует, что знак (µ1 - µ1,с) противоположен знаку
(х2 – х2,с), и поэтому  (4)
(4)
1.4 ГЕОМЕТРИЧЕСКАЯ ИНТЕРПРЕТАЦИЯ УСЛОВИЯ УСТОЙЧИВОСТИ ПО ОТНОШЕНИЮ К ДИФФУЗИИ
Так же, как и в случае системы, состоящей из одного вещества критической точки в двойной системе указывает на существование некоторой непрерывной последовательности состояния между двумя фазами, которые становятся идентичными в критической точке.
Так, на рис.5 видно, что в системе гексан — нитробензол, повышая температуру выше 19°, можно перейти от слоя, богатого гексаном, к слою, богатому нитробензолом, не наблюдая ни на одной из стадий этого процесса возникновения новой фазы.
Поэтому обе части кривой 3 на рис. 8 можно рассматривать как отрезки непрерывной кривой FBMNAE на рис.9. Так же можно показать, что состояния между М и N неустойчивы и характеризуются условием
 (5)
(5)
в то время как ВМ и AN соответствуют метастабильным состояниям. Граница между метастабильностью и неустойчивостью определяется точкой, в которой
 (6)
(6)

условию устойчивости (1) можно придать форму
 (7)
(7)
Это неравенство имеет простой геометрический смысл. Бели при постоянных Т и р откладывать g как функцию х2, то (7) означает, что, для того чтобы система была устойчивой, эта кривая должна быть обращена выпуклостью вниз (см. рис.10, кривая 1).
Если кривая имеет вид 2 и между (некоторыми значениями х2 имеется участок, обращенный выпуклостью вверх, то в этой области ( N М) система не может находиться в состоянии устойчивого равновесия и распадается на две фазы.

Рис.9. Изменение химического потенциала с составом при постоянных Т и р.

Рис.10. Изменение средней свободной энергии Гиббса ( g = G /п) с составом при постоянных Т и р.
Мольные доли x 2 ’ и x2’ компонента 2 в этих двух находящихся в равновесии фазах могут быть рассчитаны следующим образом.
Так как µ является парциальной мольной величиной, g определяется соотношением
 (8)
(8)
Используя
 получим
получим
 (9)
(9)
Условием истинного равновесия по отношению к распределению компонента 2 между фазами является
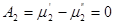
или
 (10)
(10)
Аналогично, исходя из A1 = 0, найдем
 (11)
(11)
Подставляя в (10) значения
х1 = 1 — х2 и  получим
получим
 (12)
(12)
Вычитая (11) из (12), видим, что в состоянии истинного равновесия
 (13)
(13)
Подставив это выражение в (12), получим
 (14)
(14)
Условия (13) и (14) также имеют простой геометрический смысл.
Значения х2, соответствующие двум находящимся в равновесии фазам, т. е. х2' и х2", таковы, что функции g ’ и g ” имеют общую касательную АВ (см. рис.10). Легко показать, что отрезки AN и MB соответствуют состояниям метастабильного равновесия, склонным к превращению в двухфазную систему.
В связи с

условиям (2) и (4), выполняющимся в критической точке, можно придать вид
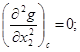

 (15)
(15)
|
из
5.00
|
Обсуждение в статье: КРИТИЧЕСКИЕ ЯВЛЕНИЯ В ДВОЙНЫХ СМЕСЯХ |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы





