 |
Главная |
Идеальные и реальные газы
|
из
5.00
|
Тема 1.1: «Законы идеальных газов»
Введение
Основные понятия термодинамики. Параметры термодинамической системы
Термодинамика - это наука, изучающая законы превращения энергии в различных процессах, сопровождающихся тепловыми эффектами. Термодинамика – наука, базирующаяся на основных законах природы (первом и втором началах термодинамики), привлекая для своих исследований опытные данные.
Масса. Все тела в природе материальны и обладают определенной массой. Масса тела характеризует свойство его инертности, то есть свойство тела сохранять приобретенное движение или состояние покоя.
Плотностью ρ вещества принято называть отношение массы тела к его объему, или массу тела, содержащуюся в единице объема. Измеряется плотность в кг/м3.
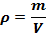
В термодинамике часто приходится иметь дело с изменением плотности тел в результате их сжатия, нагревания, охлаждения и т.д. При этом масса тела остается постоянной, а плотность изменяется только в связи с изменением объема тела. В этом случае удобнее применить понятие удельного объема тел – величины, обратной плотности вещества.
Удельным объемом ϑназывается объем, занимаемый единицей массы вещества. Измеряется удельный объем в м3/кг или см3/г.
 =1/ρ
=1/ρ
Давление Р. Давление определяется как отношение силы, действующей по нормали (то есть перпендикулярно) к поверхности тела, на единицу площади этой поверхности. Давление измеряется в паскалях (Па=Н/м2).
Давление жидкостей, паров и газов измеряют приборами барометрического типа для определения абсолютного давления или приборами манометрического типа для определения избыточного или манометрического давления.
P =  Рабс=Ризб+Ратм
Рабс=Ризб+Ратм
Температура Т. Температура важнейший термодинамический параметр состояния вещества. Температура есть мера нагретости тела. Температура всех частей изолированной системы, находящейся в равновесии, одинакова. Если система не находится в равновесии, то между ее частями, имеющими различную температуру, происходит теплообмен.
Температура тела, измеренная термометром, называется эмпирической (t).
Шкала Кельвина (или абсолютная температурная шкала) – шкала, в которой температура замерзания воды принята равной 273,15 K, а температура ее кипения – 373,15 K. Температуру, отсчитываемую по абсолютной шкале, называют абсолютной. Температуру, равную 0 К, называют абсолютным нулем.
Между абсолютной и эмпирической температурой, измеренной в градусах Цельсия, существует зависимость
Т=273,15+ t , К
Термодинамическая система (ТС), или тело – это такая равновесная система, которая способна обмениваться с другими телами энергией и веществом. Различают понятия открытой, закрытой и изолированной термодинамической систем. Открытая ТС может обмениваться веществом с другими системами. Закрытая ТС не может обмениваться веществом с другими системами. Изолированная ТС не может обмениваться энергией и веществом с другими системами.
Если термодинамическая система не обменивается теплотой с окружающей средой, то такая система называется адиабатической.
Совокупность последовательных состояний, проходящих термодинамической системой, называется термодинамическим процессом.
Внутренняя энергия тела или системы тел следует называть совокупность всех видов энергии (кинетической, химической, потенциальной и т.д.), заключенной в рассматриваемой системе. Измеряется в джоулях (Дж).
Теплота – это количество энергии, передаваемой от одного тела к другому путем непосредственного соприкосновения (теплопроводности) и излучеия.
Теплообмен - это форма передачи энергии от одних тел к другим путем теплопроводности.
Идеальные и реальные газы
Превращение теплоты в механическую работу в тепловых установках происходит при участии рабочего тела, которым является газ или пар.
Реальными газами называются газы, молекулы которых имеют конечный объем, между ними существуют силы притяжения. В общем случае — газообразное состояние реально существующего вещества. С позиции молекулярной теории строения вещества реальный газ — это газ, свойства которого зависят от взаимодействия и размеров молекул. Зависимости между его параметрами показывают, что молекулы в реальном газе взаимодействуют между собой и занимают определённый объём. Молекулы газа заключенного в сосуд, находятся в непрерывном хаотическом движении. При этом они сталкиваются друг с другом и со стенками сосуда. Таким образом, молекулы обладают кинетической энергией. А так как между молекулами существуют силы сцепления, то они обладают еще и определенной потенциальной энергией взаимодействия, которая зависит от расстояния между ними.
Для простоты изучения свойств газообразного рабочего тела введено понятие - идеальный газ. Это позволяет вести расчеты для реальных газов по уравнениям, выведенным для идеальных газов, что упрощает сами расчеты и понимание сущности процессов, протекающих в газах.
Идеальным называют воображаемый газ, в котором молекулы рассматриваются как материальные точки, обладающие массой, но не имеющие объема, между которыми отсутствуют силы взаимодействия.
Газы, которые встречаются на практике, называют реальными.
|
из
5.00
|
Обсуждение в статье: Идеальные и реальные газы |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

