 |
Главная |
Натрия тиосульфат (Natrii thiosulfas)
|
из
5.00
|
Na2S2O3 x 5H2O
Natrium thiosulfuricum
Natrium hyposulfurosum
Натрия гипосульфит
М.в. 248,18
Описание: бесцветные прозрачные кристаллы без запаха, солоновато-горького вкуса. В теплом сухом воздухе выветривается, во влажном воздухе слегка расплывается. При температуре около 50оС плавится в кристаллизационной воде.
Растворимость: очень легко растворим в овде, практически нерастворим в спирте.
Подлинность:
1. На тиосульфат-ион:
1.1.Образование опалесценции вследствие выпадения осадка серы и появлению запаха (диоксида серы) при добавлении хлороводородной кислоты.
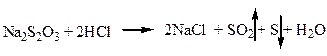
1.2. Образование осадка тиосульфата серебра при добавлении к водному раствору препарата нитрата серебра. В результате внутримолекулярной окислительно-восстановительной реакции тиосульфат серебра разлагается до серебра сульфида.

2. На натрий: желтое окрашивание бесцветного пламени горелки.
Чистота:
- Прозрачность и цветность раствора.
- Щелочность.
- Хлориды.
NaCl + AgNO3 = AgCl (белый творожистый осадок, раств в избытке раствора аммиака) + NaNO3
- Сульфиты, сульфаты.
- Сульфиды.
- Кальций.
- Тяжелые металлы.
- Железо.
- Мышьяк и селен.
Количественное определение:
Йодометрия. Прямое титрование. Метод основан на натрия тиосульфата.
Около 0,5 г препарата (точная навеска) растворяют в 25 мл воды и титруют 0,1 н раствором йода (индикатор – крахмал).
1 мл 0,1 н раствора йода соответствует 0,02482 г натрия тиосульфата, которого в препарате должно быть не менее 99,0% и не более 102,0%.
Т – 0,1М раствор йода
Индикатор – крахмал
f = 1

Хранение: в хорошо укупоренной таре.
Применение: детоксицирующее и десенсибилизирующее средство (внутрь и в/в), иногда применяют наружно как инсектицидное.
Фенобарбитал (Phenobarbitalum)
Люминал (Luminalum)
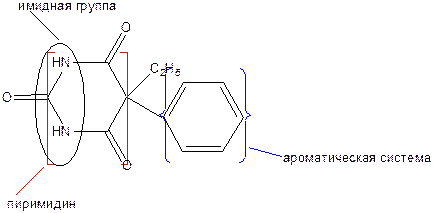
5-Этил-5-фенилбарбитуровая кислота
М.в. 232,24
Фенобарбитал относится к производным барбитуровой кислоты.
Описание: белый кристаллический порошок без запаха слабо горького вкуса.
Растворимость: очень мало растворим в холодной воде, трудно растворим в кипящей воде и хлороформе, легко растворим в 95% спирте и растворах щелочей, растворим в эфире.
Подлинность:
- ИК-спектр в области 4000-400 см-1 должен совпадать со спектром стандарта.
- УФ-спектр в области 220-280 нмимеет максимум и минимум поглощения при 240 и 224 нм соответственно (р-р в этаноле).
- Тпл 174 – 178оС.
- Реакция комплексообразования. Реакция основана на способности фенобарбитала образовывать комплексы с солями тяжелых металлов. Препарат растворяют в спирте, прибавляют каплю раствора хлорида кальция, раствор нитрата кобальта (II), раствора натрия гидроксида.

- Реакция комплексообразования. К препарату прибавляют натрия гидроксид, калия карбонат и гидрокарбонат, раствор меди сульфата. Появляется бледно-сиреневое окрашивание, не изменяющееся при стоянии.
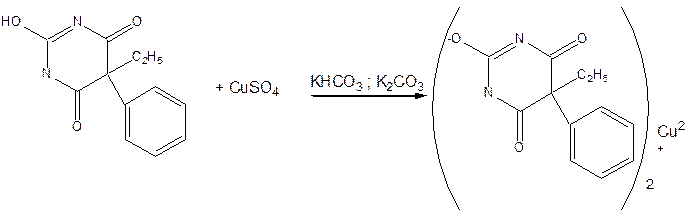
- Не ГФХ. Реакция щелочного гидролиза. Барбитураты – внутренние амиды, и, значит, способны гидролизоваться за счет амидных групп. Гидролиз идет в жестких условиях – при сплавлении с кристаллическим NaOH. В результате чего выделяется аммиак, который обнаруживают по запаху и по посинению лакмусовой бумаги.

Если далее реакционную смесь подкислить соляной кислотой, выделяется углекислый газ в виде пузырьков и ощущается запах диалкилуксусной кислоты.

- Реакция нитрования на фенильный радикал в пятом положении. Появляется желтое окрашивание, обусловленное образованием м-нитропроизводного.

Чистота:
- Прозрачность и цветность.
- Хлориды.
- Сульфаты.
- Фенилбарбитуровая кислота. Данная примесь проявляет более сильные кислотные свойства (К=4х10-5), чем фенобарбитал. Фенилбарбитуровую кислоту можно легко обнаружить потенциометрически по значению рН суспензии фенобарбитала с водой (5,0 – 6,0).
- Органические примеси.
- Сульфатная зола и тяжелые металлы.
Количественное определение:
Алкалиметрия. Метод основан на слабых основных свойствах фенобарбитала.
Растворитель – диметилформамид.
Индикатор – нейтрализованный по тимоловому синему в ДМФА.
Т – 0,1М натрия гидроксид.

Хранение: список Б, в хорошо укупоренной таре.
Применение: снотворное, противосудорожное.
Задача № 30
Глюкоза (Glucosum)
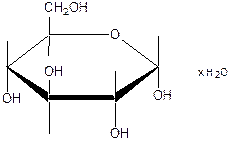
D(+)-глюкопираноза
М.в. 198,17
Глюкоза является углеводом.
Описание: бесцветные кристаллы или белый мелкокристаллический порошок без запаха сладкого вкуса.
Растворимость: растворим в 1,5 ч воды, трудно растворим в спирте, практически нерастворим в эфире.
Подлинность:
4. ИК-спектр должен совпадать со спектром стандарта.
5. Удельное вращение от +51,5о до +53о (10% водный раствор). Определение удельного вращения глюкозы имеет свои особенности. В свежеприготовленных растворах глюкозы происходит мутаротация (изменение во времени величины угла вращения; через определенный временной интервал эта величина становится постоянной). Мутаротацию ускоряют путем добавления к раствору глюкозы аммиака (не более 0,1%).
Явление мутаротации: при растворении глюкозы, которая в кристаллическом состоянии находится в какой-либо одной циклической форме, образуется ее альдегидная форма, через которую получаются аномерные циклические формы глюкохы: альфа и бета формы, различающиеся расположением полуацетального гидроксила относительно 1-ого углеродного атома. Для альфа-D-глюкозы величина угла вращения составляет +109,6о, а для бета-D-глюкозы +20,5о. Конечное значение угла вращения соответствует состоянию равновесия между альфа и бета формами, которые через альдегидную группу в растворе превращаются друг в друга:

6. Реакция окисления с реактивом Фелинга. Реакция основана на восстанавливающих свойствах глюкозы. К водному раствору препарата добавляют реактив Фелинга, нагревают до кипения. Выпадает красный осадок оксида меди (I).


Чистота:
11. Прозрачность и цветность раствора.
12. Кислотность. К водному раствору препарата добавляют несколько капель ф/ф и натрия гидроксида. Должно появиться розовое окрашивание.
13. Хлориды.
14. Сульфаты (не более 0,02%).
15. Кальций (не допустимо). При добавлении раствора оксалата аммония не должно быть помутнения.

16. Барий.
17. Мышьяк.
18. Декстрин. Водный раствор препарата нагревают. При добавлении спирта раствор должен оставаться прозрачным.
19. Потеря в весе при высушивании.
20. Сульфатная зола и тяжелые металлы.
Количественное определение:
Не ГФХ
Обратный йодометрический метод. Метод основан на окислении альдегидной группы щелочными растворами йода до образования натриевой соли глюконовой кислоты.

f = ½
Т – р-р йода 0,1М
Индикатор – крахмал

Хранение: в хорошо укупоренной таре.
Вопрос: Ампулы и флаконы с раствором глюкозы пожелтели.
Ответ: Вероятно, глюкоза подвергалась воздействию высокой температуры, так как при данных условиях вещество карамелизуется, окисляется до молочной, глюкуроновой кислоты, фурфурола (при это раствор желтеет). Для предотвращения данных реакций оксиления используют стабилизатор Вейбеля, состоящий из натрия хлорида (5,2), кислоты хлористоводородной 8,3% (4,4.мл) на 1 л раствора.
|
из
5.00
|
Обсуждение в статье: Натрия тиосульфат (Natrii thiosulfas) |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

