 |
Главная |
ТРЕБОВАНИЯ К ОФОРМЛЕНИЮ
|
из
5.00
|
ОТЧЁТА ПО ЛАБОРАТОРНОЙ РАБОТЕ
По окончании опыта экспериментальные данные и все наблюдения следует записать в лабораторный журнал (специальную тетрадь).
Лабораторную работу следует оформлять с новой страницы по следующему плану.
1. Название лабораторной работы и опыта.
2. Цель работы.
3. Реактивы и оборудование.
4. Содержание работы [уравнения химических реакций, краткое их описание, условия опыта, наблюдаемые явления (выпадение или растворение осадка, изменение цвета, выделение или поглощение теплоты, выделение газа), полученные данные и результаты].
5. Выводы (после каждого опыта и лабораторной работы в целом).
Записи в лабораторном журнале должны быть аккуратными, с достаточно широкими интервалами между строками и полями, содержать ответы на вопросы, сформулированные в методическом руководстве лабораторной работы, таблицы и рисунки.
Расчёты следует приводить полностью, не опуская промежуточных вычислений.
Указания по оформлению лабораторной работы, приводимые в методическом руководстве, необходимо выполнить все без исключения.
ПРИМЕРЫ РЕШЕНИЙ ЗАДАЧ
ПО ТЕМЕ "ЖЁСТКОСТЬ ВОДЫ"
Задача 1.
Рассчитайте общую жёсткость воды, если в её 0,25 л содержится 16,20 мг Са(НСО3)2, 2,92 мг Мg(НСО3)2, 11,10 мг СаСl2 и 9,50 мг МgСl2.
Решение.
Дано:
 = 16,20 мг;
= 16,20 мг;  = 2,92 мг;
= 2,92 мг;
 = 11,10 мг;
= 11,10 мг;  = 9,50 мг; Vводы = 0,25 л.
= 9,50 мг; Vводы = 0,25 л.
Найти:
ЖО. – ?
Формула для расчёта общей жёсткости воды:
ЖО =  , (1)
, (1)
где Мэкв(В) – эквивалентная масса вещества В.
Эквивалентные массы растворённых солей вычислим по формуле:
 =
=  , (2)
, (2)
где М– молярная масса вещества, г/моль;
N – число катионов в формульной единице соли;
Z – модуль1 заряда катиона в соли.
 =
=  = 81,05
= 81,05  =
= 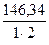 = 73,17
= 73,17
 =
=  = 55,5
= 55,5  =
=  = 47,6
= 47,6
Определим общую жёсткость воды по формуле (1):
ЖО = 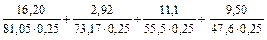 = 2,56 (ммоль/л).
= 2,56 (ммоль/л).
По значению жёсткости исследуемая вода является мягкой.
Задача 2.
Для устранения общей жёсткости к 50 л воды добавлено 7,4 г Са(ОН)2 и 5,3 г Nа2СО3. Рассчитайте временную, постоянную и общую жёсткость воды.
Решение.
Дано:
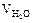 = 50 л;
= 50 л;  = 7,4 г;
= 7,4 г;  = 5,3 г.
= 5,3 г.
Найти:
ЖК., ЖНК., ЖО – ?
При добавлении к воде гашёной извести Са(ОН)2 можно устранить временную жёсткость, а при добавлении кальцинированной соды Nа2СО3 – и временную, и постоянную.
М(НСО3)2 + Са(ОН)2 = МСО3↓ + СаСО3↓ + 2Н2О
М(НСО3)2 + Nа2СО3 = МСО3↓ + 2NаНСО3
МСl2 + Nа2СО3 = МСО3↓ + 2NаСl
(М – катион жёсткости)
Постоянную (некарбонатную) жёстокость воды находим по количеству добавленной к раствору соды по формуле:
ЖНК =  , (3)
, (3)
а временную (карбонатную) жёсткость воды – по количеству добавленной извести:
ЖК =  (4)
(4)
Эквивалентную массу соды вычислим по формуле (2):
 =
=  = 53 (г/моль).
= 53 (г/моль).
Эквивалентную массу извести (основания) определим по формуле:
 =
=  ; (5)
; (5)
где N – кислотность основания – число ионов ОН в формульной единице основания, которые замещаются на кислотные остатки.
 =
=  = 37,05 (г/моль).
= 37,05 (г/моль).
Определим жёсткость воды:
ЖК =  = 0,004 (моль/л) или 4 (ммоль/л);
= 0,004 (моль/л) или 4 (ммоль/л);
ЖНК =  = 0,002 (моль/л) или 2 (ммоль/л);
= 0,002 (моль/л) или 2 (ммоль/л);
ЖО = 4 + 2 = 6 (ммоль/л).
По значению жёсткости исследуемая вода является средней жёсткости.
Задача 3.
Определите жёсткость воды для устранения которой в 0,1 м3 воды требуется 21,2 г карбоната натрия.
Решение.
Дано:
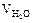 = 0,1 м3 = 100 л;
= 0,1 м3 = 100 л;  = 21,2 г.
= 21,2 г.
Найти:
Ж – ?
При добавлении карбоната натрия (кальцинированной соды) можно устранить как временную, так и постоянную жёсткость воды.
По формуле (2) вычислим эквивалентную массу карбоната натрия:
 =
=  = 53 (г/моль).
= 53 (г/моль).
По формуле (3) определим жёсткость воды:
ЖО =  = 0,004 (моль/л) или 4 (ммоль/л).
= 0,004 (моль/л) или 4 (ммоль/л).
По значению жёсткости исследуемая вода является средней жёсткости.
Задача 4.
Общая жёсткость воды равна 6,52 ммоль/л, а временная – 3,32 ммоль/л. Какую массу Nа2СО3 и Са(ОН)2 надо взять для устранения жёсткости 5 л воды ?
Решение.
Дано:
ЖК = 3,32 ммоль/л; ЖО = 6,52 ммоль/л; 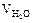 = 5 л.
= 5 л.
Найти:
 и
и  – ?
– ?
Определим некарбонатную (постоянную) жёсткость:
ЖНК = ЖО – ЖК (6)
ЖНК = 6,52 – 3,32 = 3,2 (ммоль/л)
Воспользуясь формулами (3) и (4), запишем выражения для определения масс гашёной извести и кальцинированной соды, которые необходимо последовательно добавить в воду для устранения её временной и постоянной жёсткости.
 = ЖК ·
= ЖК ·  · V;
· V;
 = ЖНК ·
= ЖНК ·  · V.
· V.
По формулам (2) и (5) вычислим эквивалентные массы извести и соды:
 =
=  = 37,05 (г/моль);
= 37,05 (г/моль);
 =
=  = 53 (г/моль),
= 53 (г/моль),
следовательно:
 = 3,32 · 37,05 · 5 = 615,03 (мг) или 0,615 (г).
= 3,32 · 37,05 · 5 = 615,03 (мг) или 0,615 (г).
 = 3,2 · 53 · 5 = 848 (мг) или 0,848 (г).
= 3,2 · 53 · 5 = 848 (мг) или 0,848 (г).
Задача 5.
Сколько по массе гидроксида кальция (гашёная известь) следует добавить в 2,5 л воды, чтобы устранить её временную жёсткость, равную 4,43 ммоль/л ?
Решение.
Дано:
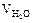 = 2,5 л; ЖК = 4,43 ммоль/л.
= 2,5 л; ЖК = 4,43 ммоль/л.
Найти:
 – ?
– ?
Воспользуясь формулой (4) запишем выражение для определения массы гашёной извести, необходимой для устранения временной жёсткости воды.
 = ЖК ·
= ЖК ·  · V.
· V.
Эквивалентную массу извести вычислим по формуле (5):
 =
=  = 37,05 (г/моль),
= 37,05 (г/моль),
следовательно,
m = 4,43 · 2,5 · 37,05 = 410,32 (мг) или 0,41 (г).
Задача 6.
В 10 л воды с общей жёсткостью 6,05 ммоль/л для устранения жёсткости добавлено 1,5 г гашёной извести. Чему равна постоянная жёсткость воды ?
Решение.
Дано:
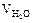 = 10 л; ЖО = 6,05 ммоль/л.
= 10 л; ЖО = 6,05 ммоль/л.
Найти:
ЖНК – ?
При добавлении к воде Са(ОН)2 произойдёт устранение карбонатной (временной) жёсткости.
По формулам (2) и (4) определим эквивалентную массу извести и карбонатную жёсткость воды.
 =
=  = 37,05 (г/моль);
= 37,05 (г/моль);
ЖК = 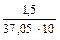 = 0,00405 (моль/л) или 4,05 (ммоль/л)
= 0,00405 (моль/л) или 4,05 (ммоль/л)
Постоянную (некарбонатную) жёсткость воды вычислим по формуле (6):
ЖНК = 6,05 – 4,05 = 2,0 (моль/л)
Задача 7.
Вода обладает некарбонатной жёсткостью: содержит сульфат кальция (массовая доля 0,02 %) и хлорид магния (массовая доля 0,01 %). Какой объём раствора карбоната натрия с массовой долей 15 % (ρ = 1,16 г/мл) надо добавить к 100 л воды для устранения постоянной жесткости ?
Решение.
Дано:
 = 0,02 %;
= 0,02 %;  = 0,01 %;
= 0,01 %;
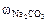 = 15 % = 0,15;
= 15 % = 0,15;  = 1,16 г/мл; VВ = 100 л.
= 1,16 г/мл; VВ = 100 л.
Найти:
ЖНК,  – ?
– ?
Жёсткость воды показывает, какое количество вещества эквивалента солей кальция и магния (в ммоль/л) содержится в 1 л воды. Поэтому сначала определим массу солей кальция и магния, содержащихся в 1 л (ρ = 1 г/мл) воды:
 =
=  =
=  = 0,2 (г)
= 0,2 (г)
 =
=  =
=  = 0,1 (г)
= 0,1 (г)
По формуле (2) определим эквивалентные массы солей СаSО4 и МgСl2, а также Nа2СО3:
 =
=  = 68 (г/моль);
= 68 (г/моль);  =
=  = 47,5 (г/моль);
= 47,5 (г/моль);
 =
=  = 53 (г/моль).
= 53 (г/моль).
Кальциевую и магниевую жёсткость воды находим следующим образом::
 =
=  =
=  = 0,00294 (моль/л);
= 0,00294 (моль/л);
 =
=  =
=  = 0,00210 (моль/л)
= 0,00210 (моль/л)
Отсюда находим суммарную некарбонатную жёсткость воды:
0,00294 + 0,00210 = 0,00504 моль/л или 5,04 ммоль/л
Применяя формулу (3), и выражая массу соды через объём, плотность и концентрацию её раствора:
 =
=  ·
·  ·
· 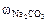
определим, какой объём раствора соды необходим, чтобы устранить некарбонатную жёсткость.
ЖНК = 
 =
=  =
=  = 153,5 (мл).
= 153,5 (мл).
Задача 8.
Минеральная вода содержит 389,4 мг/л ионов кальция и 84,4 мг/л ионов магния. Какова общая жёсткость этой воды ?
Решение.
Дано:
 = 389,4 мг/л;
= 389,4 мг/л;  = 84,4 мг/л; V – 1 л.
= 84,4 мг/л; V – 1 л.
Найти:
ЖО – ?
Так как жёсткость воды выражают суммой ммоль эквивалентов ионов кальция и магния, то 1 ммоль эквивалентов ионов жёсткости отвечает содержанию 20,04 мг/л Са2+ или 12,16 мг/л Мg2+.
Общую жёсткость воды вычислим по формуле (1):
ЖО =  = 19,43 + 6,94 = 26,37 (ммоль/л)
= 19,43 + 6,94 = 26,37 (ммоль/л)
По значению жёсткости исследуемая вода является средней жёсткости.
Задача 9.
Сравните жёсткость природной воды озера Байкал и Каспийского моря, если содержание ионов кальция (в мг/л) в озере – 15,2, а в море – 36,0; а содержание ионов магния соответственно – 4,2 и 730,0.
Решение.
Дано:
 = 15,2 мг;
= 15,2 мг;  = 4,2 мг;
= 4,2 мг;
 = 36,0 мг;
= 36,0 мг;  = 730,0 мг.
= 730,0 мг.
Найти:
Ж1, Ж2 – ?
Вычислим общую жёсткость воды в озере Байкал и Каспийском море по формуле (1), учитывая, что в 1 ммоль эквивалентов ионов жёсткости содержится 20,04 мг/л Са2+ или 12,16 мг/л Мg2+. Если учесть, что концентрация дана в мг/л, то объём воды можно взять равным 1 л и получим:
Ж1 =  = 1,1 (ммоль/л)
= 1,1 (ммоль/л)
Ж2 =  = 61,83 (ммоль/л)
= 61,83 (ммоль/л)
По значениям жёсткости вода Каспийского моря очень жёсткая, а вода озера Байкал очень мягкая.
Задача 10.
При определении временной (карбонатной) жёсткости воды на титрование 100 мл воды израсходовано 5,25 мл раствора хлороводородной (соляной) кислоты с молярной концентрацией эквивалента 0,101 моль/л, а для определения постоянной (некарбонатной) жёсткости воды на титрование такого же объёма воды – 8,5 мл раствора трилона Б с молярной концентрацией эквивалента 0,05 моль/л. Чему равна общая жёсткость воды ?
Решение.
Дано:
Vр-ра НСl = 5,25 мл;  = 0,101 моль/л; VВ = 100 мл.
= 0,101 моль/л; VВ = 100 мл.
Vтр.Б = 8,5 мл;  = 0,05 моль/л; VВ = 100 мл.
= 0,05 моль/л; VВ = 100 мл.
Найти:
ЖО – ?
При титровании воды соляной кислотой протекает реакция:
М(НСО3)2 + 2НС1 = МС12 + 2СО2↑ + 2Н2О.
В соответствии с законом эквивалентов число моль эквивалентов соляной кислоты, пошедшей на титрование, равно количеству моль эквивалентов солей, обуславливающих временную жёсткость воды:
ЖК =  · 103 =
· 103 = 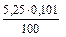 · 103 = 5,30 (ммоль/л).
· 103 = 5,30 (ммоль/л).
При взаимодействии трилона Б с солями кальция и магния выполняется закон эквивалентов, следовательно общая жёсткость воды будет равна:
ЖНК =  · 103 =
· 103 = 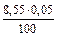 · 103 = 4,25 (ммоль/л).
· 103 = 4,25 (ммоль/л).
Общая жёсткость воды равна сумме карбонатной и некарбонатной жесткостей:
ЖО = ЖК + ЖНК = 5,30 + 4,25 = 9,55 (моль/л).
Исследуемая вода является жёсткой.
ЗАДАЧИ
- Чему равна жёсткость воды – раствора хлорида кальция с молярной концентрацией эквивалента 0,05 моль/л ?
- В 100 л воды содержится 2 г сульфата кальция, 1,5 г сульфата магния и 4,6 г гидрокарбоната магния. Какова общая, временная и постоянная жёсткость воды ?
- При определении общей жёсткости воды на титрование 100 мл воды израсходовано 9,5 мл раствора трилона Б с молярной концентрацией эквивалента 0,05 моль/л. Какова общая жёсткость воды ?
- Жёсткость воды равна 4,5 ммоль/л. Какую массу гашёной извести необходимо добавить к 2 м3 такой воды, чтобы устранить её временную жёсткость ?
- К 3 м3 воды для устранения её жёсткости добавили 468 г карбоната натрия. Какова жёсткость данной воды ?
- Жёсткость воды равна 5,4 ммоль/л. Какую массу ортофосфата натрия необходимо добавить к 1 м3 воды, чтобы устранить её жёсткость ?
- Временная жёсткость воды, обусловленная ионами кальция, равна 3,0 ммоль/л. Какая масса гидрокарбоната кальция содержится в 10 л этой воды ?
- Для определения временной жёсткости воды к 100 мл её было прилито 12 мл раствора соляной кислоты с молярной концентрацией 0,01 моль/л до нейтрализации. Чему равна временная жёсткость этой воды ?
- Какую массу гашёной извести надо прибавить к 2 м3 воды, чтобы устранить её временную жёсткость, равную 5,2 ммоль/л ?
10. Какова временная жёсткость воды, если на её устранение в 200 л воды было затрачено 8 г гидроксида натрия?
11. Чему равна жёсткость воды, если для её устранения в 2 м3 воды добавлено 2 кг древесной золы, содержащей 20 % поташа К2СО3.
12. Общая жёсткость воды равна 4,72 ммоль/л, а временная – 1,15 ммоль/л. Какую массу Са(ОН)2 и Nа2СО3 надо добавить к 3,5 л воды, чтобы устранить жёсткость?
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Каково назначение технических жидкостей ?
2. Основные требования, предъявляемые к техническим жидкостям (вязкость, теплоёмкость, температуры кипения и кристаллизации (замерзания), накипе- и шламообразование, агрессивность (коррозионные свойства), коэффициент объёмного расширения, стоимость, доступность, вспениваемость, пожаробезопасность, безвредность (экологические свойства).
3. Каков химический состав воды ?
4. Какова структура жидкой и твёрдой воды ?
5. Температура плавления и температура кипения воды, её зависимость от давления.
6. Пресная вода, её количество и нахождение на планете (льды, вечные снега и мерзлота, озёра, реки, грунтовые воды).
7. Состав природных вод: катионы и анионы, газы, органические вещества, взвеси, эмульсии.
8. Применение воды в быту, сельском хозяйстве и промышленности.
9. Качественное и количественное (визуально-органолептическое) определение прозрачности (мутности) воды и обнаружение нефтепродуктов в воде.
10. Что такое рН и как его определяют?.
11. Определение содержания взвешенных частиц в воде.
12. Охарактеризуйте понятия ‹‹индикатор›› (метилоранж, лакмус, фенолфталеин, универсальный индикатор), ‹‹свидетель››, ‹‹комплексон›› (трилон Б), ‹‹внутрикомплексное (хелатное) соединение››, ‹‹буферная смесь››,приведите примеры.
13. Что называют жёсткостью воды ?
Почему жёсткость воды следует устранять ?
14. За счёт чего в природе образуется жёсткая вода ?
15. Какие виды жёсткости воды различают ?
Чем обуславливается временная и постоянная жёсткость воды ?
16. Перечислите методы устранения жёсткости воды.
17. Какой метод умягчения воды называют термическим ?
Какие химические реакции протекают при умягчении воды этим методом ?
18. В чём сущность химических (реагентных) методов умягчения воды ?
Какие реагенты при этом используются и какие реакции при этом протекают ?
19. Охарактеризуйте ионно-обменный метод умягчения воды ?
20. Перечислите основные физические методы снижения жёсткости воды.
21. Какие преимущества имеют физические методы уменьшения жёсткости воды по сравнению с другими методами ?
ПРИЛОЖЕНИЕ
|
из
5.00
|
Обсуждение в статье: ТРЕБОВАНИЯ К ОФОРМЛЕНИЮ |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

