 |
Главная |
Проверка домашнего задания. Обобщение и систематизация полученных знаний
|
из
5.00
|
Обобщение и систематизация полученных знаний
Выставление оценок
Домашняя работа: Подготовить доклад на тему: Определение молярной массы эквивалента веществ, участвующих в используемых решениях.
СРСП № 17
На тему:Вычисления в весовом анализе. Расчет массы навески анализируемого образца и перевод её в раствор
Цель:
Обучающая– глубокое изучение различных явлений и законов по данной теме
Развивающая – формирование эффективных и устойчивых взаимосвязей между научной и образовательной деятельностью;
Воспитательная – приобщать обучающихся к активности, самостоятельности на занятиях
Ход урока:
1. Организационный этап- 3 минуты
2. Этап подготовки к усвоению материала СРСП -5 минут
3. Проверка домашнего задания- 27 минут
4. Обобщение и систематизация полученныхзнаний - 5 минут
5. Выставление оценок- 5 минут
В гравиметрическом анализе применяют метод отгонки и метод осаждения.
В методе отгонки определения содержания интересующего компонента проводят по разности масс навески анализируемого вещества до и после термической обработки, что не требует каких-либо дополнительных расчетов.
В методе осаждения, который включает в себя несколько этапов, следует теоретически обосновывать с помощью расчетов каждый из них
Расчет навески анализируемого вещества.
При расчете навески анализируемого вещества необходимо определить стехиометрические коэффициенты из уравнений реакций осаждения и прокаливания.
Кроме того, следует учитывать тип образующегося осадка. Если образуется кристаллический осадок, то рекомендуемая масса весовой формы составляет 0,5г, если осадок аморфный, то рекомендуемая масса весовой формы 0,1г.
Пример: Рассчитать навеску анализируемого вещества Fe(NO3)3×9H2O, необходимую для определения железа, если при осаждении аммиаком образуется аморфный осадок, состав весовой формы Fe2O3.
Решение:
Fe(NO3)3×9H2O + 3NH4OH ® Fe(OH)3¯ + 3NH4NO3 + 9H2O
анализируемое осадитель осаждаемая
вещество форма
2Fe(OH)3  Fe2O3 + 3H2O
Fe2O3 + 3H2O
весовая
форма
Схема последовательных превращений:
2Fe(NO3)3×9H2O ® 2Fe(OH)3 ® Fe2O3
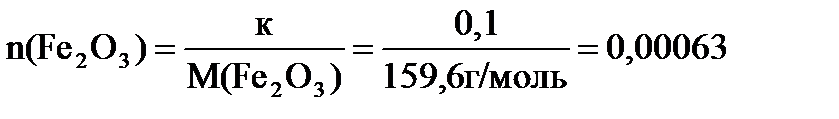 моль,
моль,
к = 0,1, т.к. осадок аморфный.
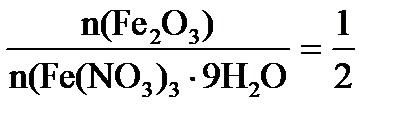
n(Fe(NO3)3×9H2O = 2n(Fe2O3) = 2×0,00063 = 0,00126 моль
m(Fe(NO3)3×9H2O) = n(Fe(NO3)3×9H2O) × M(Fe(NO3)3×9H2O) = 0,00126 моль × 403,8 г/моль = 0,5088 г.
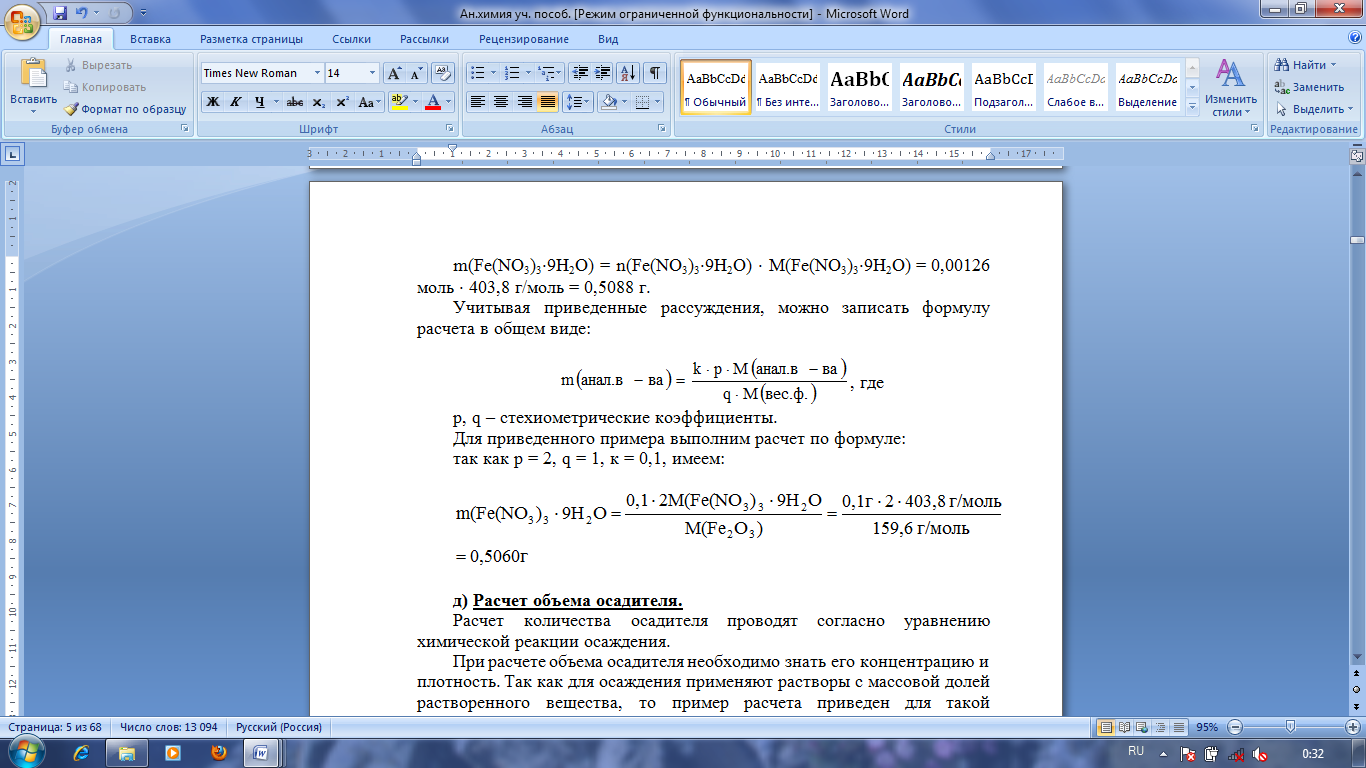
Учитывая приведенные рассуждения, можно записать формулу расчета в общем виде:
 , где
, где
p, q – стехиометрические коэффициенты.
Для приведенного примера выполним расчет по формуле:
так как р = 2, q = 1, к = 0,1, имеем:
Проверка домашнего задания
Обобщение и систематизация полученных знаний
Выставление оценок
Домашняя работа: Подготовить доклад на тему: Индикаторы и принцип их выбора, интервал перехода окраски индикатора, показатель титрования. Кривые титрования
СРСП № 18
На тему:Получение формы осаждения
Цель:
Обучающая– глубокое изучение различных явлений и законов по данной теме
Развивающая – формирование эффективных и устойчивых взаимосвязей между научной и образовательной деятельностью;
Воспитательная – приобщать обучающихся к активности, самостоятельности на занятиях
Ход урока:
1. Организационный этап- 3 минуты
2. Этап подготовки к усвоению материала СРСП -5 минут
3. Проверка домашнего задания- 27 минут
4. Обобщение и систематизация полученныхзнаний - 5 минут
5. Выставление оценок- 5 минут
|
из
5.00
|
Обсуждение в статье: Проверка домашнего задания. Обобщение и систематизация полученных знаний |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

