 |
Главная |
Проверка домашнего задания. Обобщение и систематизация полученных знаний
|
из
5.00
|
Обобщение и систематизация полученных знаний
Выставление оценок
Домашняя работа: Подготовить доклад на тему: Расчет рН в водных растворах сильных и слабых кислот и оснований. Буферное действие.
СРСП № 20
На тему:Сущность метода нейтрализации, его индикаторы, показатель титрования, выбор индикатора, кривые титрования.
Цель:
Обучающая– глубокое изучение различных явлений и законов по данной теме
Развивающая – формирование эффективных и устойчивых взаимосвязей между научной и образовательной деятельностью;
Воспитательная – приобщать обучающихся к активности, самостоятельности на занятиях
Ход урока:
1. Организационный этап- 3 минуты
2. Этап подготовки к усвоению материала СРСП -5 минут
3. Проверка домашнего задания- 27 минут
4. Обобщение и систематизация полученныхзнаний - 5 минут
5. Выставление оценок- 5 минут
а) Расчет концентрации ионов водорода (рН)
В основе метода нейтрализации лежит реакция взаимодействия:
Н+ + ОН- ® Н2О
В процессе титрования происходит изменение концентрации ионов Н+ или ОН-. Поэтому основными расчетами является вычисление рН и рОН. Исходя из ионного произведения воды:
 = c(H+)×c(ОH-) = 10-14 , логарифмируя
= c(H+)×c(ОH-) = 10-14 , логарифмируя
 = -lgc(H+) - lgc(OH-) = -lg10-14
= -lgc(H+) - lgc(OH-) = -lg10-14
 = рН + рОН = 14
= рН + рОН = 14
Расчет рН и рОН в растворах сильных электролитов.
Сильные электролиты практически полностью диссоцируют на ионы, поэтому концентрация ионов Н+ или ОН- определяется исходной концентрацией кислоты или щелочи.
Пример: с(НСІ) = 0,1 моль/л, рН - ?
Решение: НСl ® Н+ +Сl-, с(Н+ ) = с(НСІ) = 0,1 = 10-1 моль/л
рН =- lgc(H+) = -lg10-1 = 1
Пример: с(КОН) = 0,1 моль/л, рН - ?
Решение: КОН ® К+ +ОН-, с(ОН) = с(КОН) = 0,1 = 10-1 моль/л
рOН =-lgc(OH-) = -lg10-1 = 1
pH = 14 – 1 = 13
Расчет рН и рОН в растворах слабых электролитов.
Слабые электролиты диссоциируют на ионы частично, поэтому концентрация ионов Н+ или ОН- зависит от константы диссоциации соответствующей кислоты или основания.
Пример: с(СН3СООН) = 0,1 моль/л, Кд = 1,75×10-5, pH - ?
Решение: СH3COOH = СН3СОО- + Н+;  , т.к.
, т.к.
с(СН3СОО-) = с(Н+), то  или
или
с(H+) = 

Пример: с(NH4OH) = 0,1 моль/л, Kд= І,79×10-5, pH - ?
Решение: NH4OH ® NH  + OH-,
+ OH-,  , т.к
, т.к
C(NH  ) = c(OH-), то
) = c(OH-), то  или
или
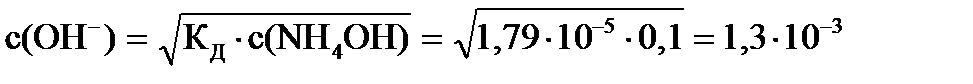
pOH = -lg1,3×10-3 = 2,88
рН = 14-2,88 = 11,12
Как видно из приведенных примеров, для сильной кислоты рН меньше, чем для слабой той же концентрации, а для щелочи больше, чем для слабого основания, что согласуется с теорией электролитической диссоциации.
Проверка домашнего задания
Обобщение и систематизация полученных знаний
Выставление оценок
Домашняя работа: Подготовить доклад на тему: Константы равновесия ОВР. Скорость и механизм ОВР.
СРСП № 21
На тему:Расчет и построение кривых титрования.
Обучающая– глубокое изучение различных явлений и законов по данной теме
Развивающая – формирование эффективных и устойчивых взаимосвязей между научной и образовательной деятельностью;
Воспитательная – приобщать обучающихся к активности, самостоятельности на занятиях
Ход урока:
1. Организационный этап- 3 минуты
2. Этап подготовки к усвоению материала СРСП -5 минут
3. Проверка домашнего задания- 27 минут
4. Обобщение и систематизация полученныхзнаний - 5 минут
5. Выставление оценок- 5 минут
Расчет и построение кривых титрования.
Необходимость расчета и построения кривых титрования обусловлена выбором подходящего индикатора, чтобы исключить перетитрование или недотитрование анализируемого раствора при фиксировании точки эквивалентности. При расчете кривых титрования обычно выбирают начальную точку, несколько точек ближе к точке эквивалентности, где рН меняется резко, точку эквивалентности и несколько точек, когда добавлен избыток титранта, чтобы иметь величину скачка титрования, чем определяется выбор индикатора. Изменением объема в процессе титрования при расчетах пренебрегают.
В зависимости от природы электролитов (титруемого раствора и титранта) различают следующие случаи:
1. Сильная кислота титруется сильным основанием (или наоборот).
Пусть с(HCl) = 0,1 моль/л, с(KOH) = 0,1 моль/л, исходный объем кислоты 100 мл, расчет провести для точек, когда добавлено: 0; 90; 99; 99,9; 100; 100,1; 101; 110; 200 мл титранта (КОH).
1 точка: к 100 мл HCl добавлено 0 мл КОН
с(H+) = с(НСІ) =0,1 =10-1 моль/л
рH = -lg c(H+) = -lg10-1 =1, рН =1
2 точка: к 100 мл HCl добавлено 90 мл KOH, не вступило в реакцию 10 мл, что в 10 раз меньше исходного объема, следовательно и концентрация Н+ в 10 раз меньше исходной.
с(Н+) =  = 0,01 = 10-2 моль/л
= 0,01 = 10-2 моль/л
pH = -lgc(H+) = -lg10-2 = 2, рН =2
3 точка: к 100 мл HCl добавлено 99 мл KOH, не вступило в реакцию 1 мл кислоты, что в 100 раз меньше исходного объема, следовательно и концентрация Н+ в 100 раз меньше исходной.
с(Н+) = 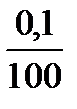 = 0,001 = 10-3 моль/л
= 0,001 = 10-3 моль/л
pH = -lgc(H+) = -lg10-3 = 3, рН = 3
4 точка: к 100 мл HCl добавлено 99,9 мл KОH, не вступило в реакцию 0,1 мл кислоты, что в 1000 раз меньше исходного объема, следовательно и концентрация Н+ в 1000 раз меньше исходной.
с(Н+) =  = 0,0001 = 10-4 моль/л
= 0,0001 = 10-4 моль/л
pH = -lgc(H+) = -lg10-4 = 4, рН = 4
5 точка: точка эквивалентности – к 100 мл HCl добавлено 100 мл КОН, произошла полная нейтрализация:
НСІ + КОН ® КС1 + Н2О
рН в этом случае определяется ионным произведением воды.
с(Н+) = с(ОН-) = 10-7 моль/л
pH = -lgc (H+) = -lg10-7 = 7, рН = 7
6 точка: к 100 мл НСІ добавлено 100,1 мл КОН, избыток щелочи составил 0,1 мл, это в 1000 раз меньше максимально заданного избыточного объема в 100 мл, соответственно концентрация ОН- в 1000 раз меньше 0,1 моль/л.
с(ОН-) = 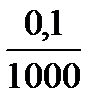 = 0,0001 = 10-4 моль/л
= 0,0001 = 10-4 моль/л
pОH = -lgc(ОH-) = -lg10-4 = 4, рОН = 4
рН = 14 – 4 = 10
7 точка: к 100 мл НСІ добавлено 101мл КОН, избыток щелочи 1 мл, это в 100 раз меньше максимально заданного избыточного объема в 100 мл, соответственно концентрация ОН- в 100 раз меньше 0,1 моль/л.
с(ОН-) =  = 0,001 = 10-3 моль/л
= 0,001 = 10-3 моль/л
pH = -lgc(ОH-) = -lg10-3 = 3
рН = 14 – 3 = 11
8 точка: к 100 мл НСІ добавлено 110 мл КОН, избыток щелочи10 мл, это в 10 раз меньше максимально заданного избыточного объема в 100 мл соответственно концентрация ОН- в 10 раз меньше 0,1 моль/л.
с(ОН-) =  = 0,01 = 10-2 моль/л
= 0,01 = 10-2 моль/л
pОH = -lgc(ОH-) = -lg10-2 = 2, рОН =2
рН = 14-2 = 12
9 точка: к 100 мл НСІ добавлено 200 мл КОН, избыток щелочи 100 мл, концентрация которого 0,1 моль/л.
с(ОН-) = с(КОН) = 0,1 = 10-1 моль/л
pОH = -lgc(ОH-) = -lg10-1 = 1
рН = 14 - 1 = 13
Используя полученные данные строят кривую титрования.
|
из
5.00
|
Обсуждение в статье: Проверка домашнего задания. Обобщение и систематизация полученных знаний |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

