 |
Главная |
Проверка домашнего задания. Обобщение и систематизация полученных знаний
|
из
5.00
|
Обобщение и систематизация полученных знаний
Выставление оценок
Домашняя работа: Подготовить доклад на тему: Графический метод изображения процесса ОВР. Фиксирование т.э. в методах окисления восстановления.
СРСП № 22
На тему:Методы оксидиметрии
Цель:
Обучающая– глубокое изучение различных явлений и законов по данной теме
Развивающая – формирование эффективных и устойчивых взаимосвязей между научной и образовательной деятельностью;
Воспитательная – приобщать обучающихся к активности, самостоятельности на занятиях
Ход урока:
1. Организационный этап- 3 минуты
2. Этап подготовки к усвоению материала СРСП -5 минут
3. Проверка домашнего задания- 27 минут
4. Обобщение и систематизация полученныхзнаний - 5 минут
5. Выставление оценок- 5 минут
В основе методов оксидиметрии лежит какая-либо окислительно-восстановительная реакция, которая должна быть необратимой и протекать с высокой скоростью. Поэтому для определения направления реакции используют соответствующие расчеты.
а) Определение возможности протекания ОВР в заданном направлении.
Направление протекания ОВР определяется электродными потенциалами пар, участвующих в реакции.
Если DЕ = Е0окисл. – Е0вос. > 0, реакция идет в прямом направлении,
в противном случае, в обратном.
Для примера рассмотрим реакции восстановления железа (III) иодид и хлорид ионами, если стандартные электродные потенциалы имеют следующие значения:
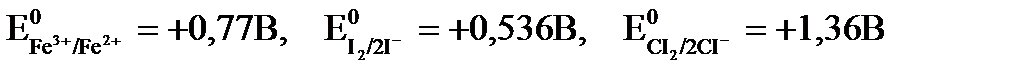
Fe3+ + 2I- ® Fe2+ + I2
DЕ = Е0окисл. – Е0вос. = 0,77 – 0,536 = +0,234 В > 0, следовательно реакция протекает в прямом направлении.
Fe3+ + 2CI- ® Fe2+ + CI2
DЕ = Е0окисл. - Е0вос. = 0,77 – 1,36 = -0,59 В < 0, следовательно реакция в прямом направлении протекать не может.
Степень необратимости ОВР тем больше, чем больше разница значений электродных потенциалов.
Однако, не всегда разность стандартных электродных потенциалов может дать однозначный ответ о направлении протекания ОВР.
б) Расчет реального электродного потенциала.
Реальный электродный потенциал определяется уравнением Нернста:
Е = Е0 + 
В тех случаях, когда в окислительно-восстановительной реакции принимают участие кислородсодержащие ионы, на ход ОВР оказывает влияние рН среды.
Так, для реакции: MnO4- + 8H+ + 5ē ® Mn2+ + 4H2O
Е = Е0 + 
Пример: Определить возможность реакций окисления хлорид, бромид, иодид ионов перманганат ионом при рН=5, рН=3, рН = 1, если 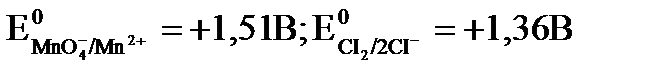

Решение: Согласно Е, рассчитанной на основе Е0, перманганат ион может окислять все ионы (CI-, Br-, I-). В зависимости от рН среды реальный электродный потенциал для окислителя будет изменяться.
а) рН = 5 с(Н+) =10-5 , пусть с(МnO  ) = c(Мn2+) = 1 моль/л
) = c(Мn2+) = 1 моль/л
тогда:
 В этих условиях перманганат ион может окислять только иодид ионы, так как: DЕ = 1,04 – 1,36 = - 0,22 В < 0 (для хлорид ионов)
В этих условиях перманганат ион может окислять только иодид ионы, так как: DЕ = 1,04 – 1,36 = - 0,22 В < 0 (для хлорид ионов)
DЕ = 1,04 – 1,07 = - 0,03 В < 0 (для бромид ионов)
DЕ = 1,04 – 0,54 = + 0,50 В > 0 (для иодид ионов)
б) рН = 3 с(Н+) = 10-3, пусть с(MnO  ) = c(Mn2+) = 1 моль/л
) = c(Mn2+) = 1 моль/л
тогда: 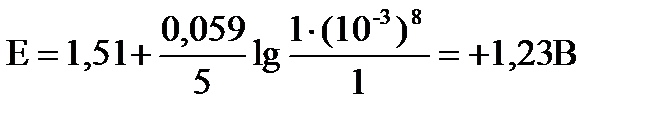
В этих условиях перманганат ион может окислять иодид и бромид ионы, так как: DЕ = 1,23 – 1,36 = -0,13 В < 0 (для хлорид ионов)
DЕ = 1,23 – 1,07 = +0,16 В > 0 (для бромид ионов)
DЕ = 1,23 – 0,54 = +0,69 В > 0 (для иодид ионов)
в) рН = 1 с(Н+) = 10-1, пусть с(MnO  ) = c(Mn2+) = 1 моль/л
) = c(Mn2+) = 1 моль/л
тогда: Е = 1,51 + 
В этих условиях пермангшанат ион может окислять иодид, бромид и хлорид ионы, так как: DЕ = 1,42 – 1,36 = +0,06 В > 0 (для хлорид ионов)
DЕ = 1,42 – 1,07 = +0,35 В > 0 (для бромид ионов)
DЕ = 1,42 – 0,54 = +0,88 В > 0 (для иодид ионов)
Как видно из приведенных примеров, окислительная активность перманганат иона увеличивается с увеличением кислотности среды.
Также, при решении вопроса о направлении протекания ОВР, следует учитывать процессы комплексообразования и формирование (возникновение или исчезновение) фаз. При этом концентрация окисленной или восстановленной форм значительно понижается (определяется значениями Кнест. или ПР), что влияет на величину реального потенциала.
|
из
5.00
|
Обсуждение в статье: Проверка домашнего задания. Обобщение и систематизация полученных знаний |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

