 |
Главная |
Проверка домашнего задания. Обобщение и систематизация полученных знаний
|
из
5.00
|
Обобщение и систематизация полученных знаний
Выставление оценок
Домашняя работа: Подготовить доклад на тему: Эквивалентная масса окислителя и восстановителя, определение и использование в расчетных формулах, задачах.
СРСП № 19
На тему:Способы выражения концентрации растворов
Цель:
Обучающая– глубокое изучение различных явлений и законов по данной теме
Развивающая – формирование эффективных и устойчивых взаимосвязей между научной и образовательной деятельностью;
Воспитательная – приобщать обучающихся к активности, самостоятельности на занятиях
Ход урока:
1. Организационный этап- 3 минуты
2. Этап подготовки к усвоению материала СРСП -5 минут
3. Проверка домашнего задания- 27 минут
4. Обобщение и систематизация полученныхзнаний - 5 минут
5. Выставление оценок- 5 минут
В титриметрическом анализе основным приемом является процесс титрования, который заключается в том, что к известному объему раствора (аликвотной части) анализируемого вещества добавляется небольшими порциями раствор титранта с известной концентрацией (стандартный раствор). Конец титрования определяют визуально с помощью индикаторов и отмечают объем титранта, пошедший на титрование. Все эти данные используют для расчета концентрации анализируемого раствора, согласно следствию из закона эквивалентов:
сЭ(ан. в-ва)×V(ан. в-ва) = сЭ(титр.)×V(титр.), где
сЭ(ан.в-ва) – молярная концентрация эквивалента определяемого компонента в анализируемом вещества (моль/л), которую необходимо найти.
V(ан.в-ва) – объем аликвотной части анализируемого вещества, взятый для титрования (отбирают пипеткой) (мл).
сЭ(ан.в-ва) – молярная концентрация эквивалента титранта (стандартный раствор) (моль/л).
V(титр.) – объем титранта, пошедший на титрование (измеряют по бюретке) (мл).
а) Массовая доля растворенного вещества показывает массу растворенного вещества в 100г раствора, выражают в частях или %:
w(x) = 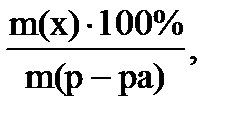 где
где
m (р-ра) = m(х) + m(растворителя)
В качестве растворителя чаще используют воду.
Для перехода к объему раствора учитывают его плотность:
V(р-ра) = 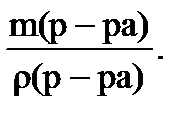
Растворы такой концентрации не имеют достаточной точности, поэтому их применяют в качестве осадителя или для создания среды.
б) Молярная концентрация показывает число моль растворенного вещества в 1 литре раствора, выражают в моль/л (также обозначают М):
с(х) = 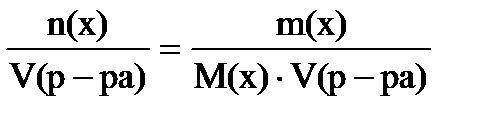
Объем раствора обязательно в литрах!
Такие растворы готовят по точной навеске в мерных колбах. Они имеют точную концентрацию и их используют в качестве титрантов.
в) Молярная концентрация эквивалента показывает число моль эквивалента растворенного вещества в 1 литре раствора, выражают в моль/л (также обозначают н или N):
сэ(х) = 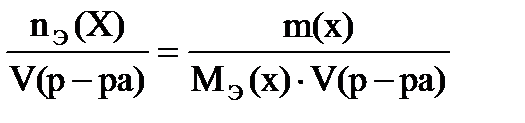
Объем раствора обязательно в литрах!
Эти растворы, как и молярные, имеют точную концентрацию, но их в аналитической химии в качестве титрантов применяют более широко, так как в основе расчетов по результатам титрования лежит закон эквивалентов.
Определение молярной массы эквивалента связано с молярной массой числом эквивалентности:
МЭ(х) = 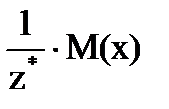 , где
, где
z*- число эквивалентности равное валентности металла, основности кислоты или кислотности основания, для реакций обмена – числу Н+ или ОН- вступивших в реакцию, для ОВР – числу электронов, принятых окислителем или отданных восстановителем.
г) Титр показывает массу растворенного вещества в 1 мл раствора, выражают г/мл: 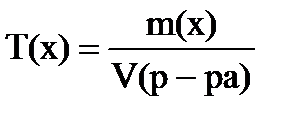
Объем раствора обязательно в миллилитрах!
Титр связан с молярной концентрацией эквивалента соотношением:
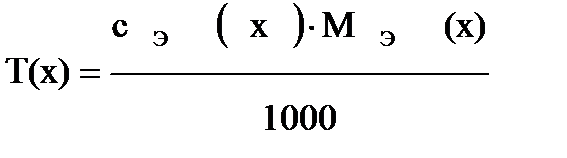
Важное значение в аналитической химии имеет титр по определяемому веществу, что значительно сокращает расчеты:
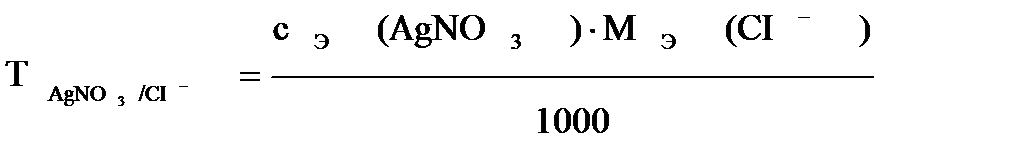 , где
, где
AgNО3 – титрант,
CI- - определяемый ион.
Приведенные далее индивидуальные задания (таблицы 5-8) рекомендуются для самостоятельного решения.
Таблица 5
Закончить уравнения химических реакций, для ОВР составить электронный баланс. Определить молярные массы эквивалентов реагирующих веществ в реакциях обмена, окислителя и восстановителя в ОВР:
| № | Реакция обмена | Реакция ОВР |
| НBг + NH4 OH® | КМnО4+КNО2+H2SО4 ® МnSO4+К2SO4+КNO3+ H2О | |
| H2SO4 + NaOH® | KCIO3+HCl + FeCl2 ® FeCl3 + KCl +H2O | |
| H2SO4 + Ca(OH)2 ® | Cr Cl3+Br2+KOH ® K2CrO4+KCl+KBr+H2O | |
| Mg(OH)2 + HCl ® | К2Cг2O7+H2S+H2SO4 ®Cr2(SO4)3+K2SO4+S + H2O | |
| H2CO3 + 1KOH ® | FeCl3 + КІ ® FeCl2 + I2 + КСІ | |
| A1(OH)3 +2HNO3 ® | KMnO4+H2SO4+FeSО4®MnSO4+Fe2(SO4)3+K2SО4+H2O | |
| H3PO4 + 1KOH ® | K2Cr2O7 ® FeCI2 + HCI ®CrCI3+FeCI3 +KCl+H2O | |
| HCl + KOH ® | Nа2SO3 + H2SO 4 ® Nа2SO4+ SО2 + H2О | |
| H3PO4 + 3KOH ® | HBr+H2SO4 ® Br2 +SO2+H2O | |
| Н2SО4 + ВаCІ2 ® | H2SO4+H2S ® S+H2O | |
| Fe(ОН)3 + 1HСІ ® | HNO2+KI+H2SO4 ®NO+I2+K2SO4+H2O | |
| Zn(OH)2 + 2HCl ® | К3AsО4 + КI +H2SO4 ® К3AsО3+I2+ К2SО4+H2O | |
| HNO3 + KOH ® | FеСІ3 + SnСІ2 ® FeCl2+SnCl4 | |
| H3РO4 + 2KOH ® | КMnO4+ К2SО3 +H2SO4 ® МnSO4 +К2SO4+H2О | |
| АgNО3 + КСІ ® | FeSО4 + НNO3 +H2SО4 ® Fе2(SO4)3+NO+H2O |
|
из
5.00
|
Обсуждение в статье: Проверка домашнего задания. Обобщение и систематизация полученных знаний |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

