 |
Главная |
Индикаторы в методе кислотно-основного титрования
|
из
5.00
|
Общая характеристика метода
К методу кислотно-основного титрования (нейтрализации) относят все определения, которые основаны на реакции взаимодействия кислот и оснований с образованием малодиссоциирующих молекул воды:

или

В зависимости от титранта различают ацидиметрическое и алкалиметрическое титрование. В методе ацидиметрии в качестве титрантов применяют сильные кислоты. Этим методом определяют сильные и слабые основания, соли слабых кислот и органических соединений, обладающих основными свойствами.
В методе алкалиметрического титрования в качестве титрантов применяют сильные основания. Методом алкалиметрии определяют сильные и слабые кислоты, соли слабых оснований и органических соединений, обладающих кислыми свойствами.
Основными рабочими растворами в методе кислотно-основного титрования являются чаще всего кислоты HCl и H2SO4 и растворы щелочей NaOH и KOH. Так как эти вещества не удовлетворяют требованиям, предъявляемым к стандартным веществам, из них готовят растворы приблизительной концентрации, которые затем стандартизируют.
В качестве стандартных веществ при установке точной концентрации кислот используют тетраборат натрия (буру) Na2B4O710H2O или безводный карбонат натрия Na2CO3.
Для установки титра щелочей используют щавелевую кислоту H2C2O4 · 2H2O, янтарную кислоту H2C4H4O4, бензойную кислоту C6H5COOH и др.
Так как реакция нейтрализации не сопровождается каким-либо внешним эффектом, точку эквивалентности определяют по изменению окраски индикатора, который добавляют в титруемый раствор.
Индикаторы в методе кислотно-основного титрования
Индикаторами в методе кислотно-основного титрования служат вещества, меняющие свою окраску при изменении рН среды. Поэтому их называют кислотно-основными, или рН-индикаторами. Наиболее широко используются в анализе: метиловый оранжевый, фенолфталеин, лакмус, метиловый красный, тимолфталеин, бромтимоловый синий.
Сделать правильный выбор индикатора для титриметрического анализа можно лишь зная теорию индикаторов. Существует так называемая ионно-хромофорная теория индикаторов, объясняющая свойства таких индикаторов. Согласно ионной теории индикаторы, используемые в методе кислотно-основного титрования, – это слабые органические кислоты (или слабые органические основания), у которых недиссоциированные молекулы и образуемые ими ионы имеют различную окраску.
Индикаторы, обладающие свойством присоединять протоны, называют основными индикаторами (IndOH). Такие индикаторы диссоциируют по схеме
IndOH + H+  Ind+ + H2O (12.2.1)
Ind+ + H2O (12.2.1)
Индикаторы, обладающие свойством отдавать протоны, называют кислотными индикаторами (HInd). Если упрощенно обозначить молекулы фенолфталеина через HInd, а анионы его – через Ind -, то можно записать следующее уравнение:
HInd 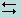 H+ + Ind - (12.2.2)
H+ + Ind - (12.2.2)
бесцветная малиновая
Достаточно к раствору, содержащему фенолфталеин, прибавить немного щелочи, как введенные ОН--ионы станут связывать Н+-ионы с образованием малодиссоциирующих молекул Н2О. Равновесие диссоциации индикатора сместится вправо, и накопление анионов Ind - вызовет окрашивание раствора в малиновый цвет.
Наоборот, если к раствору фенолфталеина прилить несколько капель кислоты, то будет подавляться диссоциация молекул индикатора. Равновесие сместится влево, и раствор обесцветится.
Согласно хромофорной теории молекулы кислотно-основных индикаторов содержат так называемые хромофоры (носители цветности), т. е. особые группы атомов с сопряженными двойными связями и неподеленными парами электронов:
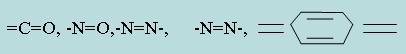
При изменении рН раствора или при диссоциации хромофоры могут перегруппировываться. Перемена окраски у индикаторов – результат изменений в их внутреннем строении. У одноцветных индикаторов это связано с появлением или исчезновением хромофоров. У двухцветных индикаторов эти изменения обусловлены превращением одних хромофоров в другие, имеющих различную окраску. Этот процесс называется таутомерией.
Переход из одной таутомерной формы в другую происходит под действием ионов Н+> и ОН-, поскольку одна из форм индикатора является слабой органической кислотой или слабым органическим основанием. На окраску индикаторов влияет также присутствие в соединениях других группировок, называемых ауксохромами. К ним относятся группы -OH, -NH2, -OCH3, -N(CH3)2 и т. д.
Ауксохромы сами не сообщают окраску индикаторам, но обладают свойством усиливать действие хромофоров, повышать интенсивность вызываемой ими окраски.
Таким образом, в растворах кислотно-основных индикаторов одновременно происходят как равновесные процессы, обусловленные диссоциацией молекул, так и равновесные процессы, связанные с внутримолекулярной группировкой.
Свойство молекул различных индикаторов диссоциировать в нейтральной среде характеризуется константами диссоциации. Например, у метилового оранжевого  , у фенолфталеина
, у фенолфталеина  .
.
Взаимосвязь между константой диссоциации индикатора и значением рН, где происходит изменение его окраски, можно вывести из общих соображений диссоциации индикатора (уравнение (12.2.2)) с учетом З.Д.М. для равновесных концентраций:
 (12.2.3)
(12.2.3)
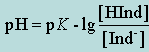 (12.2.4)
(12.2.4)
С учетом того, что обычно способность человека к восприятию окраски возможна, когда присутствие одной из окрашенных форм приблизительно в 10 раз больше концентрации другой, получим


 (12.2.5)
(12.2.5)
т. е. интервал значений рН, в пределах которого индикатор изменяет свою окраску, простирается обычно на одну единицу рН в ту или другую сторону от величины рК индикатора. Этот интервал перехода окраски индикатора называют также областью перехода. В Приложении 5 указаны интервалы перехода окраски некоторых индикаторов. Например, область перехода метилового оранжевого простирается от 3,1 до 4,4. При рН > 4,4 метилоранж сохраняет желтую окраску, при рН < 3,1 – розовую. Внутри этого интервала происходит изменение окраски от розового цвета до желтого.
В ходе титрования раствор титранта приливают до отчетливого изменения окраски индикатора. Значение рН, при котором наблюдается резкое изменение окраски индикатора, называют показателем титрования рТ. Например, у фенолфталеина значение рТ = 9, у метилового оранжевого рТ = 4. Обычно величина рТ находится внутри интервала перехода.
Для того чтобы погрешность титрования была наименьшей, надо чтобы изменение окраски индикатора происходило как можно ближе к точке эквивалентности (т. е. конечная точка титрования как можно больше соответствовала точке эквивалентности).
Неправильный выбор индикатора может исказить результат анализа. Чтобы этого не произошло, необходимо в каждом определении представлять, каким образом происходит изменение рН в процессе титрования, в какой среде лежит точка эквивалентности, как резко изменяется рН вблизи точки эквивалентности. Эти процессы описывают кривые титрования.
При выборе индикатора руководствуются следующим правилом: для каждого данного титрования можно применять только те индикаторы, показатели титрования которых лежат в пределах скачка рН на кривой титрования, т. е. у правильно выбранного индикатора интервал перехода полностью или частично перекрывается скачком титрования на данной кривой.
|
из
5.00
|
Обсуждение в статье: Индикаторы в методе кислотно-основного титрования |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

