 |
Главная |
Кривые окислительно-восстановительного титрования
|
из
5.00
|
Процессы окислительно-восстановительного титрования можно представить графически в виде кривых титрования, изображающих изменение окислительно-восстановительного потенциала титруемого раствора по мере приливания к нему стандартного раствора окислителя или восстановителя (титранта). При титровании изменяется соотношение окисленной и восстановленной форм определяемого вещества и титранта, поэтому потенциалы редокс-пар рассчитывают по уравнению Нернста

Расчет ведут по потенциалу той окислительно-восстановительной пары, компоненты которой находятся в избытке в данный момент титрования и концентрация которых легко может быть вычислена.
До точки эквивалентности потенциал рассчитывают по потенциалу пары определяемого вещества, а после точки эквивалентности – по системе титранта.
В точке эквивалентности потенциал системы определяется присутствием окислительно-восстановительных пар как определяемого вещества, так и титранта.
Поэтому потенциал в точке эквивалентности, Еэкв, можно рассчитать по уравнению, полученному суммированием уравнений потенциалов обеих пар при условии равенства в точке эквивалентности концентраций окисленных и восстановленных форм окислителя и восстановителя:
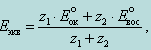 (14.2.1)
(14.2.1)
где Eºок и Eºвос – стандартные окислительно-восстановительные потенциалы систем окислителя и восстановителя, В;
z1 и z2 – число принятых окислителем или отданных восстановителем электронов.
Расчет кривых титрования проводят для нахождения скачка титрования с целью выбора подходящего редокс-индикатора. Правильно выбранным индикатором является тот индикатор, у которого потенциал перехода окраски находится в пределах скачка титрования.
Скачок титрования в редоксиметрии – это резкое изменение потенциала окислительно-восстановительной системы в пределах допустимой погрешности измерения определяемого вещества.
Рассмотрим кривую титрования 10,0 мл 0,1 н раствора FeSO4 0,1 н раствором Ce(SO4)2 в сернокислой среде.
При титровании протекает следующая реакция:
Fe2+ + Ce4+ = Fe3+ + Ce3+

1. Расчет потенциала до точки эквивалентности.
В процессе титрования до точки эквивалентности потенциал системы рассчитываем по формуле
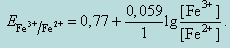
При этом
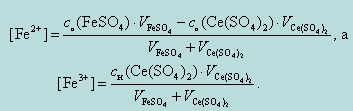
Тогда, при добавлении 0,1 мл 0,1 н раствора Ce(SO4)2, потенциал системы будет равен
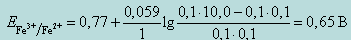
При добавлении 5,0 мл 0,1 н раствора Ce(SO4)2
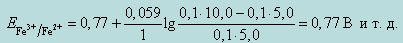
2. Расчет потенциала в точке эквивалентности.
В точке эквивалентности к 10 мл 0,1 н раствора FeSO4прибавлено 10,0 мл 0,1 н раствора Ce(SO4)2:
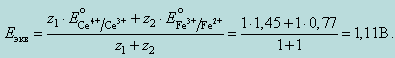
3. Расчет потенциала после точки эквивалентности.
После точки эквивалентности в избытке находится титрант, поэтому потенциал раствора рассчитываем по формуле
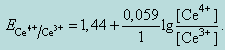
При добавлении титранта Ce(SO4)2 после точки эквивалентности
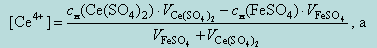
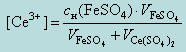
Тогда, при добавлении 10,01 мл 0,1 н раствора Ce(SO4)2, потенциал системы будет равен

При добавлении 10,10 мл 0,1 н раствора Ce(SO4)2 получим
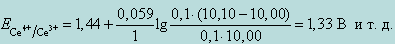
По полученным данным (см. табл. 14.2.1) можно построить кривую титрования (см. рис. 14.2.1).
Таблица 14.2.1
Расчетные данные для построения кривой титрования 10,0 мл 0,1 н раствора FeSO4 0,1 н раствором Ce(SO4)2
| № | 
| Fe3+/Fe2+ | Е, В |
| 1. | 0,10 | 10-2 | 0,65 |
| 2. | 1,00 | 10-1 | 0,71 |
| 3. | 5,00 | 0,77 | |
| 4. | 9,00 | 0,83 | |
| 5. | 9,90 | 102 | 0,90 |
| 6. | 9,99 | 103 | 0,95 |
| 7. | 10,00 | В точке эквивалентности Fe3+=Ce2+ Fe2+=Ce4+ Ce4+/Ce3+ | 1,11 |
| 8. | 10,01 | 1· 10 -3 | 1,27 |
| 9. | 10,10 | 1· 10 -2 | 1,33 |
| 10. | 11,00 | 1· 10 -1 | 1,39 |
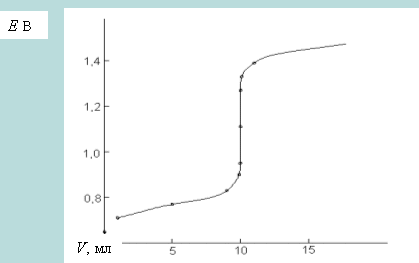
Рис. 14.2.1. Кривая титрования 0,1 н раствора FeSO4 0,1 н раствором Ce(SO4)2
Как видно из рис. 14.2.1, кривая окислительно-восстановительного титрования напоминает кривые, получаемые в методе нейтрализации. В начале титрования кривая изменяется плавно, а вблизи точки эквивалентности наблюдается резкое изменение потенциала. По резкому скачку кривой титрования устанавливают точку эквивалентности, которая не всегда лежит на середине скачка. Характер кривых титрования в редоксиметрии не зависит от разбавления раствора, если стехиометрические коэффициенты у окислителя и восстановителя одинаковы. Величина скачка титрования зависит от разности стандартных окислительно-восстановительных потенциалов редокс-пар, участвующих в реакции.
В отличие от кривых кислотно-основного титрования область скачка на кривой окислительно-восстановительного титрования можно значительно расширить, регулируя кислотность среды, используя процессы комплексообразования или образования малорастворимых соединений, т. к. в этих случаях изменяется концентрация окисленной или восстановленной форм соответствующих редокс-пар.
|
из
5.00
|
Обсуждение в статье: Кривые окислительно-восстановительного титрования |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

