 |
Главная |
Определение количества активного хлора, содержащегося в порошке хлорной извести
|
из
5.00
|
Аппаратура, материалы, реактивы. Весы лабораторные; бюкса стеклянная; колба коническая вместимостью 200 см3 с притертой пробкой; цилиндр измерительный вместимостью 50 см3; бюретка вместимостью 50 см3; пипетке вместимостью 2 см3; кислота серная, раствор с массовом долей 20%; йодид калия, раствор с массовойдолей 10%; тиосульфат натрия, раствор 0,1 моль/дм3; крахмал растворимый, раствор массовом долей 1%; вода дистиллированная.
Проведение испытания. Навеску порошка хлорной извести около 2 г (точность до 0,001 г) в стеклянной бюксе, количественно переносят в коническую колбу вместимостью 200 см3 с притертой пробкой, при трехкратном ополаскивании бюксы заранее отмеренными 50 см3 дистиллированной воды. Содержимое колбы перемешивают в течение 1 мин, затем добавляют 20 см3 раствора серной кислоты с массовой долей 20% и 20 см3 раствора йодида калия с массовой долей 10%.
Колбу закрывают пробкой, осторожно взбалтывают и ставят на 5 мин в темное место. Выделившийся йод титруют раствором тиосульфата натрия с концентрацией 0,1 моль/дм3 (0,1 н) до соломенно-желтого цвета. После этого добавляют 1 см3 раствора крахмала с массовой долей 1%и дотитровывают до полного обесцвечивания раствора.
Обработка результатов. Содержание активного хлора (Х, %) рассчитывают по формуле
Х = 
где V-объем 0,1 моль/дм3раствора тиосульфата натрия, пошедшего на титрование, см3;
К - поправочный коэффициент ктитру 0,1 моль/дм3 раствора тиосульфата натрия;
m-навеска порошка хлорной извести, г;
0,003546 - количество хлора, соответствующее 1см3 0,1 моль/дм3раствора тиосульфата натрия, г.
Пример расчета
V = 140 см3; К = 0,9804; m = 2,0 г
X =  = 24%
= 24%
По Санитарным правилам – утвержденным Министерством здравоохранения СССР, в воде второй моечной ванны должно содержаться 0,2% хлорной извести или 0,2% хлорамина. Для этого необходимо вносить 200 см3 осветленного раствора хлорной извести с массовой долей 10% или 20 г хлорамина на 10 л воды (1 ведро).
Обычно готовят раствор хлорной извести с массовой долей 10%, а затем осветленный раствор разводят, как указано выше, и получают требуемое содержание хлорнойизвести.
РАЗДЕЛ 9. ПРИГОТОВЛЕНИЕ РАСТВОРОВ РЕАКТИВОВ
РАСТВОРЫ КИСЛОТ
Серная кислота.
Исходным раствором является концентрированная серная кислота (Н2SO4), х.ч., по ГОСТ 4204-77 плотностью 1,84 г/см3. Плотность кислоты необходимо проверять с помощью ареометра.
2 моль/дм3 (4 н) раствор. Отмеряют мерным цилиндром III см3 концентрированной серной кислоты. Осторожно, небольшими порциями, при охлаждении, приливают ее к дистиллированной воде. После охлаждения объем доводят до 1000 см3.
0,5 моль/дм3 (1 н) раствор. Отмеривают мерным цилиндром 27,8см3 концентрированной серной кислоты и разбавляют дистиллированной водой до 1000 см3, как указано выше.
0,05 моль/дм3 (0,1 н) раствор. Для его приготовления 2 моль/дм3 (4 н) или 0,5 моль/дм3 (1 н) растворы разбавляют, соответственно, в 40 или 10 раз: 1 объем 2 моль/дм3 (4 н) раствора кислоты и 39 объемов дистиллированной воды или 1 объем 0,5 моль/дм3 (1 н) раствора кислоты и 9 объемов дистиллированной воды. Полученный раствор перемешивают и не ранее чем на следующий день устанавливают коэффициент поправки.
Для определения коэффициента поправки берут несколько отдельных навесок по 0,15-0,2 г подсушенного при 150°С карбоната натрия (натрия углекислого безводного), х.ч., с точностью до 0,0002 г. Их количественно переносят с помощью дистиллированной воды в коническую колбу вместимостью 250 см3 так, чтобы объем стал около 25 см3. Затем добавляют 1-2 капли раствора метилового оранжевого и титруют из бюретки приготовленным раствором кислоты до перехода желтой окраски в оранжево-розовую. Для определения коэффициента поправки можно использовать тетраборат натрия (буру); навеску берут массой около 0,5 г, растворяют и переносят ее в коническую колбу с помощью теплой дистиллированной воды в количестве 30-60 см3. Добиваются полного растворения навески. В качестве индикатора применяют раствор метиленового красного с массовой долей 1%. Затем раствор титруют, как и при использовании карбоната натрия.
Коэффициент поправки в обоих случаях вычисляют по формуле
К = 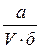 , (111)
, (111)
где К - коэффициент поправки;
V - израсходованный на титрование объем раствора, в котором устанавливают коэффициент поправки, см3;
а - навеска исходного вещества, г;
б - количество исходного вещества, соответствующее 1 см3;
0,1 моль/дм3раствора кислоты, г (для карбоната натрия б =0,0053 г, для тетрабората натрия б = 0,019072г).
0,05 моль/дм3 (0,1 н) раствор кислоты удобно готовить из фиксанала; в этом случае коэффициент поправки не устанавливают.
Коэффициент поправки 0,5 моль/дм3 (1 н) раствора серной кислоты устанавливают так, как указано для 0,05 моль/дм3 (0,1 н) раствора; при этом количество карбоната натрия и тетрабората натрия, берут в 10 раз больше; тогда величина б будет соответственно: для карбоната натрия - 0,053 г, для тетрабората - 0,19072 г.
0,01 моль/дм3 (0,02 к) раствор. Пипеткой с грушей отмеривают 0,56 см3 концентрированной серной кислоты и приливают ее к дистиллированной воде, затем объем доводят до 1000 см3.
Раствор с массовой долей 25%. Один объем концентрированной серной кислоты смешивают с пятью объемами воды.
Раствор с массовой долей 10%. Отмеривают цилиндром 59 см3 концентрированной серной кислоты и приливают к 940 см3 дистиллированной воды.
Кислота серная 1:2 по объему. Отмеривают цилиндром необходимый объем концентрированной серной кислоты и осторожно малыми порциями (при охлаждении) приливают к двухкратному объему дистиллированной воды.
Соляная кислота.
Исходным раствором является концентрированная соляная кислота (HCl), х.ч. по ГОСТ 3118-77, плотностью 1,19 г/см3, которую проверяют ареометром.
1 моль/дм3 (1 н) раствор. Отмеривают мерным цилиндром 82,2см3 концентрированной соляной кислоты и растворяют ее в дистиллированной воде. Объем доводят до 1000 см3, тщательно перемешивают и не ранее чем на следующий день устанавливают коэффициент поправки так, как указано в п. 9.1.1. для 0,5 моль/дм3 (1 н) раствора серной кислоты.
0,5 моль/дм3 (0,5 н) раствор. В2 раза разбавляют 1моль/дм3 (1 н) раствор соляной кислоты водой, то есть 1объем 1 моль/дм3 (1 н) раствора и 1 объем вода.
0,1 моль/дм3 (0,1 н) раствор. В 10 раз разбавляют 1 моль/дм3 (1 н) раствор соляной кислоты водой, то есть 1 объем 1 моль/дм3 (1 к) и 9 объемов воды. Полученный раствор тщательно перемешивают и не ранее чем на следующий день устанавливают коэффициент поправки так как указано для 0,05 моль/дм3 (0,1 н) раствора серной кислоты (п. 9.1.1).
0,1 моль/дм3 (0,1 н) раствор соляной кислоты удобно готовить из фиксанала без установления коэффициента поправки.
Растворы с массовой долей 20%, 10% и 2% (приблизительно), готовят путем разбавления, соответственно 483, 231 и 45 см3 концентрированной соляной кислоты дистиллированной водой до объема 1000 см3.
Азотная кислота.
Исходным реактивом является концентрированная азотная кислота (HNO3), х.ч., по ГОСТ 4461-77, плотностью 1,4 г/см3, которую проверяют ареометром.
Растворы с массовой долей 20% и 10% (приблизительно) готовят разбавлением, соответственно: 233 и 111 см3 концентрированной азотной кислоты дистиллированной водой до объема 1000 см3, а затем тщательно перемешивают.
Уксусная кислота.
Исходным реактивом является концентрированная уксусная кислота (С2Н4О2), х.ч., по ГОСТ 61-73 с массовой долей 96% (ледяная) или кислота уксусная лесохимическая по ГОСТ 6963-76 (раствор с массовой долей 80%).
Раствор с массовой' долей 12%. 11,6 см3 ледяной уксусной кислоты растворяют в 88 см3 дистиллированной воды. Если для приготовления раствора используют уксусную кислоту с массовой долей 80% (плотностью 1,07 г/см3), ее отмеривают в количестве 14 см3 и растворяют в 86 см3 воды.
|
из
5.00
|
Обсуждение в статье: Определение количества активного хлора, содержащегося в порошке хлорной извести |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

