 |
Главная |
Влияние условий реакции на относительное значение двух
|
из
5.00
|
Механизмов
| Механизм | Растворитель | Сила нуклеофила | Концентрация нуклеофила |
| SN1 | Протонный | Более слабый | Мéньшая |
| SN2 | Апротонный | Более сильный | Бóльшая |
Например, неопентилбромид реагирует с этоксид-ионом по SN2-механизму, а с этиловым спиртом – по SN1-механизму. Сильный нуклеофил (сильное основание), этоксид-ион, выталкивает ион галогена из молекулы, тогда как слабый нуклеофил (этиловый спирт) атакует реакционный центр, после того как галогенид-анион отойдет от реакционного центра и сформируется карбокатион.
Амбидентные ионы
Некоторые нуклеофильные реагенты обладают несколькими реакционными центрами. Примеры таких ионов представлены ниже:
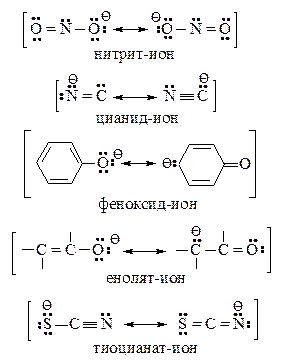
Их называют амбидентными ионами. В амбидентных ионах на атомах с большей электроотрицательностью сосредоточена большая электронная плотность (на атоме кислорода большая электронная плотность - по сравнению с атомами углерода или азота, на атоме азота – по сравнению с атомом углерода). Атомы с меньшей электроотрицательностью обладают большей нуклеофильной силой, т.е. способностью предоставлять свою пару электронов для образования новой ковалентной связи. В соответствии с правилом Корнблюма амбидентные ионы в реакциях SN2-типа атакуются по месту наибольшей нуклеофильности, а в реакциях SN1 – по месту наибольшей электронной плотности.
Замещение с участием таких нуклеофильных реагентов приводит к смеси продуктов. Например, енолят-ионы дают продукты О-алкилирования - виниловые эфиры и С-алкилирования - карбонильные соединения.
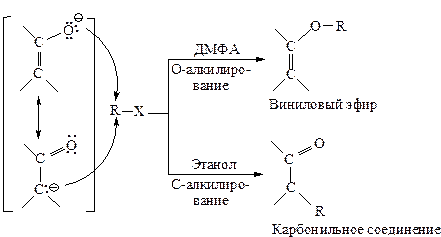
Относительная нуклеофильность обоих центров, а следовательно, и соотношение продуктов реакции определяются не только распределением электронной плотности в амбидентном ионе, но и внешними факторами: растворителем, структурой субстрата R-Х.
Влияние растворителя.При взаимодействии бромистого аллила с феноксид-ионом возможно С- и О-алкилирование. В диметиловом эфире этиленгликоля (ДМЭЭ) CH3–O–CH2–CH2–O–CH3 (апротонный растворитель) образуется аллилфениловый эфир с выходом 100 %, в феноле (протонный растворитель) в основном образуется С-аллил-фенол (77 %) а выход эфира только 23 %.
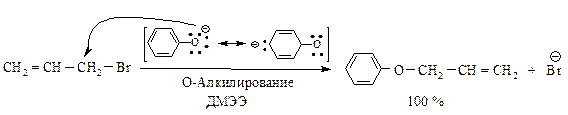
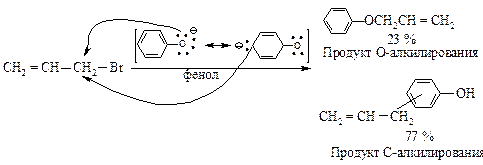
Различная нуклеофильная способность С- и О-атомов обусловлена различной сольватацией в обоих растворителях. В протонном растворителе атом кислорода (атом с большей электронной плотностью) сильнее сольватирован из-за образования водородных связей, чем атом углерода. В результате его нуклеофильная реакционная способность снижена, реакция протекает по менее сольватированному атому углерода.
В апротонном растворителе, в котором отрицательно заряженный ион практически не сольватирован, более активным нуклефильным центром является кислородный атом; протекает преимущественно О-замещение.
Природа алкильного радикала.На соотношение продуктов реакции большое влияние оказывает природа алкильного радикала R в субстрате. При взаимодействии нитрита серебра с алкилбромидом в диэтиловом эфире выход нитроалканов падает при переходе от первичного к третичному алкилгалогениду, и соответственно увеличивается выход эфира азотистой кислоты. Это является следствием изменения механизма реакции.
Первичные галогеналканы реагируют по SN2-механизму. Реакцонный центр, несущий частичный положительный заряд, атакуется атомом, обладающим большей нуклеофильностью (низкой электронной плотностью, высокой поляризуемостью). При взаимодействии первичных галогеналканов образуются преимущественно нитроалканы.
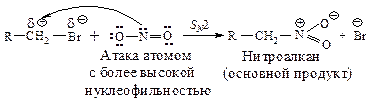
В реакциях вторичных иод- и бромалканов с нитритом серебра в эфире (реакция происходит преимущественно по SN1- механизму) выход нитросоединения составляет лишь 15 %. Третичные галогениды не дают нитроалканов, в реакции образуются эфиры азотистой кислоты (продукты SN1-реакции) и олефины (продукты Е1-реакции). Образующийся карбокатион взаимодействует с атомом, обладающим наибольшей электронной плотностью (низкой поляризуемостью), так как этот атом в состоянии сильнее электростатически притянуть образующийся карбокатион.
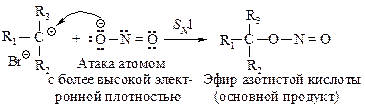
При взаимодействии алкилгалогенидов с цианидами щелочных металлов (синтез нитрилов по Кольбе) так же, как в реакции с нитритами, обычно образуется смесь двух продуктов: нитрилов и изонитрилов.
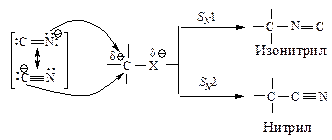
Реакции первичных алкилгалогенидов с цианидами щелочных металлов в апротонных растворителях протекают по механизму SN2, главным продуктом реакции являются нитрилы. Подобным образом можно провести реакцию с вторичными галогеналканами, но с более низкими выходами нитрилов. Третичные галогеналканы не реагируют в этом направлении.
|
из
5.00
|
Обсуждение в статье: Влияние условий реакции на относительное значение двух |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

