 |
Главная |
Общие методы получения антрахинонов
|
из
5.00
|
Из растительного сырья
Для выделения антрагликозидов растительный материал экстрагируют водой, спиртами (этиловым, метиловым) или водно-спиртовыми смесями. Агликоны лучше растворимы в органических растворителях, но растворимость их избирательная. Для получения агликонов, гликозиды в растительном материале подвергают гидролизу, нагревая с кислотой, или энзиматическому расщеплению, после чего извлекают свободные агликоны этиловым эфиром, бензолом или хлороформом. Антрахиноны, имеющие в качестве заместителя карбоксильную группу, растворяются в водных растворах карбонатов и гидрокарбонатов щелочных металлов и их гидроксидов с образованием солей. Антрахиноны с гидроксилом в b-положении не взаимодействуют с гидрокарбонатами, а с водными растворами карбонатов и гидроксидов щелочных металлов дают феноляты. Вещества, содержащие a–гидроксил, образуют феноляты только в растворах щелочей.
Сырье измельчают до размеров частиц 3-5 мм и экстрагируют при нагревании и перемешивании в экстракторах обычного типа, как правило, циклами по 2-5 часов 2-3(4) раза, либо методом противотока.
Для отделения сопутствующих веществ, экстракты объединяют, концентрируют до небольшого объема и фракционируют концентрат в соответствии с химической природой сопутствующих веществ [29].
ГЛИКОЗИДЫ
Гликозиды – многочисленная группа биологически актив-ных соединений, в составе которых содержатся различные агликоны и различные углеводные фрагменты.
Все гликозиды хорошо растворимы в воде, спиртах, водно-органических растворителях.
Агликонами гликозидов могут быть: алкалоиды, фенолы, фенолокислоты, бензофеноны, стильбены, хромоны, кумарины, ксантоны, флавоны, антраценовые и другие вещества.
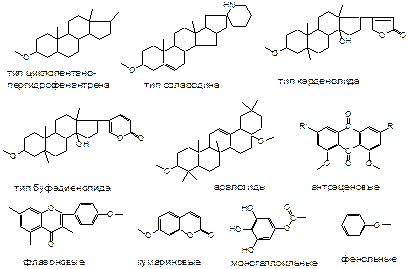
Наиболее распространенные типы гликозидов: гликоалка-лоиды, антраценовые, кумариновые, сердечные, сапонины, феноловые, фурастаноловые, флавоноидные.
По физико-химическим свойствам их разделяют на гидрофильные и гидрофобные.
Тритерпеновые, стероидные гликозиды содержат углеродный скелет, по составу кратный С5Н8 (изопрену). Это соединения циклические и с открытой С-цепью.
Гликозиды терпеноидов называют терпеновыми сапонинами, гликозиды стероидов – стероидными сапонинами:

Сапонины - вещества, обладающие значительной поверхностной активностью, что связано с наличием в одной молекуле гидрофильного и гидрофобного остатка.
Как правило, тритерпеновые гликозиды нерастворимы в хлороформе, ацетоне, петролейном эфире. Растворимость сапонинов в воде определяется в первую очередь, количеством моносахаридов и увеличивается с возрастанием числа последних. Гликозиды с 1-4 моносахаридными остатками обычно плохо растворимы в воде. Прибавление этилового эфира или ацетона к спиртовым растворам сапонинов вызывает их осаждение, что используется в качестве метода очистки.
Сапонины пенятся в водных растворах, растворимы в метаноле и этаноле (~70%) на холоду, до 90% - при кипячении, а по охлаждении выпадают в осадок.
Сапонины делят на 2 группы – нейтральные (стероидный тип) легко растворимы в воде и кислые (тритерпеновые) трудно растворимые в воде, легко – в растворах щелочей.
Сердечными гликозидами называется группа природных биологически активных веществ, оказывающих избирательное кардиотоническое действие на сердечную мышцу. Агликоном этих соединений является циклопентанпергидрофенантрен. Кроме обычных сахаров - глюкозы, фруктозы, рамнозы, в сердечных гликозидах встречаются специфические дезоксисахара: дигитоксоза и цимароза. Все природные сердечные гликозиды делятся на 2 группы: с пятичленным лактонным кольцом – карденолиды, и с шестичленным – 
буфадиенолиды:
Сердечные гликозиды также можно классифицировать и по количеству сахарных остатков в углеводной части молекулы (монозиды, биозиды, триозиды и т.д.).
Большинство сердечных гликозидов мало растворимы в этиловом эфире, хлороформе, петролейном эфире и воде, хорошо растворимы в метиловом и этиловом спирте. Увеличение растворимости сердечных гликозидов напрямую связано с длиной углеводной цепи: чем длиннее углеводная цепочка, тем лучше сердечные гликозиды растворяются в воде и водно-спиртовых смесях, тогда как агликоны сердечных гликозидов лучше растворимы в неводных растворах спиртов.
К группе фенольных гликозидов относятся вещества, при гидролизе распадающиеся на агликоны с одним или несколькими фенольными гидроксилами при одном бензольном кольце и моносахара.
Фенольные гликозиды широко представлены в растениях различных семейств: ивовые, толстянковые, розоцветные и т.д.
В зависимости от природы агликона, фенольные гликозиды можно классифицировать на 3 группы: производные гидрохинона (арбутин, метиларбутин), производные оксифенилметанола и оксифенилэтанола (салицин, салидрозид) 
и производные салициловой кислоты (сагалин):
Фенольные гликозиды хорошо растворимы в воде, этиловом спирте и ацетоне и практически не растворимы в эфире и хлороформе.
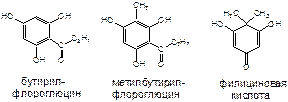 |
Флороглюциды - одна из малоизученных групп природных соединений, широко представленная в растениях рода щитовник. Флороглюциды являются моно-, ди-, три- и т.д. производными флороглюцина или пирона. Кроме того, они подразделяются на производные бутирилфлороглюцина, метилбутирилфлороглюцина и филициновой кислоты.
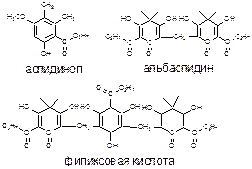 |
Сумма 3 флороглюцидов известна как «филицин» или «сырой филицин»:
Кроме того, описаны a– и b– «горькие» кислоты, являю-щиеся производными ацилфлороглюцидов и дитерпеноидов, это медицинские горечи аппетитного, желчегонного и успокоительного действия [2].
Флороглюциновые производные при отсутствии в их структуре пространственных затруднений способны к образованию межмолекулярных и внутримолекулярных связей. Они нерастворимы в воде, ограниченно растворимы в органических растворителях, хорошо растворимы в щелочах и жирных маслах.
Выделение:
1. 2-3 г измельченного растительного сырья заливают 30 мл спирта этилового 70%, и настаивают в течение суток, фильтруют, спирт отгоняют под вакуумом. Остаток обрабатывают в делительной воронке углеродом четырех-хлористым (хлороформом, хлороформ-спирт изопропило-вый 3:1), фильтруют через слой натрия сульфата.
2. Можно использовать раствор препаратов.
Качественный анализ [10,12]:
Строго специфичных реакций на наличие гликозидов нет, однако комплекс реакций на углеводную часть, основной скелет и лактонное кольцо позволяет провести их идентификацию по следующим реакциям:
q Реакция Келлер-Килиани. Готовят два раствора: 1 - ледяная уксусная кислота содержащая 0.05% железа окисного хлорида или сульфата. II-кислота серная концентрированная содержащая 0.05% железа окисного хлорида или сульфата. Добавляют сначала 2-3 капли раствора 1, а затем по стенкам пробирки 2-3 капли раствора II, на границе раздела появляется бурое окрашивание, затем верхний слой меняет окраску на васильково - синюю (дезоксисахара).
q Реакция Либермана-Бурхарда. Добавляют смесь уксусного ангидрида в кислоте серной концентрированной (50:1). Через некоторое время развивается окраска от розовой до зеленой и синей (стероидное ядро); Красно-бурое окрашивание от добавления смеси указанных реагентов в соотношении 2:1 (тритерпены), зелено-синее кольцо, затем коричнево-красное окрашивание от добавления смеси указанных реагентов 1:1 (фитостерины); устойчивое темно-зеленое окрашивание (все стерины, имеющие двойную связь в положении 5; напр. ситостерин, холестерин и др.), малиновое ТСХ силикагель (аралозиды).
q ТСХ хроматограмму обрабатывают 25% раствором кислоты трихлоруксусной в спирте этиловом 96% с добавлением 0.2% хлорамина и нагревают в сушильном шкафу при температуре 100-1050С в течение 5 минут. Образуются пятна серо-синего цвета (ланатозиды).
q К пробе в хлороформе добавляют 10 капель ангидрида уксусного, 3 капли кислоты серной концентрированной, появляются сменяющие друг друга окраски от бурой до зеленой (фитостерины).
q Реакция Розенхейма. К пробе в хлороформе добавляют 90% раствор кислоты трихлоруксусной, появляются сменяющие друг друга окраски от розовой до лиловой и интенсивно синей (стероидное ядро), выпадает осадок – белковые комплексы.
q Реакция Легаля. Готовят два раствора: 1- 1-5% раствор натрия нитропруссида, II - 10% раствор натра едкого. К спиртовому раствору пробы добавляют 1-2 капли раствора I, затем по стенке, не перемешивая, добавляют 1-2 капли раствора II. На границе растворов появляется постепенно исчезающее красное окрашивание (пятичленное лактонное кольцо; гликозиды ландыша и наперстянки).
q Реакция Раймонда. К спиртовому раствору пробы добавляют 1 мл 1% спиртового раствора мета-динитробензола и 2 капли раствора натра едкого, появляется постепенно исчезающее красно-фиолетовое окрашивание (дигитоксин, гликозиды, чувствительность 4-5 мкг).
q Добавляют 1 мл 0.05% раствора железа окисного хлорида в кислоте уксусной ледяной, затем по стенке пробирки, не перемешивая, добавляют 1-2 мл кислоты серной концентрированной. На границе раздела появляется бурое окрашивание, а верхний слой постепенно окрашивается в сине-зеленый или синий цвет (сердечные гликозиды, фенольные).
q Добавляют 2-3 капли кислоты серной концентрированной, появляется зеленое окрашивание (строфантиновые гликозиды).
q Готовят раствор пара-диметиламинобензальдегида (1 г пара-диметиламинобензальдегида смачивают 4 каплями воды, затем добавляют 3 мл кислоты серной концентрированной). Добавляют 1 каплю указанного раствора, появляется яркое окрашивание (гликозиды, терпены различного типа, фураста-ноловые гликозиды), желтое окрашивание, переходящее в малиново-красное от добавления 2-3 капель воды (ментол).
q
| |
q Реакция Бальета. Добавляют 1% раствор пикриновой кислоты в щелочной среде, появляется различное по цвету яркое окрашивание (с пятичленным гетерокольцом лактона – красное окрашивание). Аскорбиновая кислота и альдозы также дают эту реакцию, но медленно (чувствительность 2 мкг).
q Реакция Таттье. Добавляют 2-3 мл щелочного раствора 2,4-динитродифенилсульфона, появляется яркое окрашивание (дигитоксин, карденолиды).
q Добавляют 2-3 капли насыщенного раствора сурьмы (III) хлорида в спирте метиловом, появляется розово-фиолетовое окрашивание (гликозиды ландыша).
q Добавляют 1-2 капли 1% раствора ванилина в кислоте серной концентрированной, появляется красно-фиолетовое или пурпурно-красное окрашивание (терпены с С3-ОН, C3-О-caxap). Оптимальным является 65% раствор кислоты серной. Желтое окрашивание, переходящее в малиново-красное от добавления 1 мл воды (ментол). Тимол эту реакцию не дает!
q 
Гидроксамовая проба. Добавляют 1% спиртовый раствор гидроксиламина солянокислого и раствора калия едкого до рН=8, затем несколько капель кислоты хлороводородной,1-2 капли 1% спиртового раствора железа окисного хлорида, появляется фиолетовое окрашивание (терпены, сложные эфиры, платифилин).
q Реакция на пенообразование. В одну пробирку наливают 5 мл 0.1 н раствора кислоты хлороводородной, в другую - 5 мл 0.1 н раствора натра едкого. В обе пробирки добавляют по 2-3 капли исследуемого препарата и интенсивно встряхивают. Если в обеих пробирках образуется пена, равная по объему и стойкости (тритерпеновые сапонины), если в пробирке со щелочью образуется пены больше по объему и стойкости (стероидные сапонины).
q Добавляют несколько капель 1% раствора свинца ацетата, бария гидроксида или магния гидроксида, или солей меди, появляется осадок. Тритерпеновые сапонины осаждаются раствором среднего свинца ацетатом, а стероидные - основным свинца ацетатом.
q Реакция Лафона. Добавляют 1 мл кислоты серной концентрированной, 1 мл спирта этилового и 1 каплю 10% раствора железа сернокислого, нагревают, появляется сине-зеленое окрашивание (сапонины).
q Добавляют несколько капель 1% спиртового раствора холестерина, появляется осадок.
q Добавляют 1 мл 10% раствора натрия нитрата и 1 каплю кислоты серной концентрированной, появляется кроваво-красное окрашивание (терпены, сапонины).
q Реакция Сабетая. Добавляют 1 мл 1% раствора брома в хлороформе, появляется окрашивание от голубого до синего (сесквитерпены).
q ТСХ хроматограмму обрабатывают раствором кислоты фосфорно-вольфрамовой, образуются малиновые пятна на белом фоне, при обработке хроматограммы раствором кислоты фосфорно-молибденовой, образуются темно-синие пятна на желтом фоне (терпены).
q Гемолиз эритроцитов. К 1 мл на изотоническом растворе добавляют 1 мл 2% взвеси эритроцитов в изотоническом растворе. Кровь становится прозрачной, ярко-красной (сапонины).
Достаточно специфичных реакций на 6-ти членное лактонное кольцо не описано, особенно в присутствии других групп соединений в лекарственном растительном сырье и фитопрепаратах.
q Добавляют 1 мл 1% раствора железа окисного хлорида и 1 мл 1% калия ферроцианида, появляется темно-зеленое окра-шивание, переходящее в темно-бурое при добавлении 1-2 мл кислоты азотной концентрированной (флороглюциды).
q Добавляют 2-3 капли реактива Паули по Кутачеку, появляется вишнево-красное окрашивание, переходящее при стоянии в оранжевое (флороглюциды).
q Добавляют 4 мл раствора аммиака и 1 мл 10% раствора натрия фосфорномолибденовокислого в кислоте хлороводо-родной 10%, появляется синее окрашивание (арбутин).
Важную роль в технологии растительных гликозидов играют хроматографические методы. Гликозиды, содержащие свободные карбоксильные группы, могут быть отделены от сопутствующих веществ, в том числе и от минеральных примесей, с помощью ионообменной хроматографии. Хромато-графическую очистку суммы сапонинов проводят на оксиде алюминия, силикагеле, активированном угле.
В отличие от других классов природных соединений (аминокислот, углеводов и т. п.) для сапонинов нет универсальных систем элюирования. Для нейтральных сапо-нинов, наиболее подходящие системы: н-бутанол - этиловый спирт - вода; н-бутанол - уксусная кислота - вода (в различных соотношениях, верхний слой); хлороформ - метиловый спирт - вода (65:35:10) и (14:6:1); хлороформ – метиловый спирт от (4:1) до (19:1); этилацетат – метиловый спирт – вода (81:11:8); хлороформ – этиловый спирт (20:1); хлороформ - ацетон (9:1); толуол – этилацетат (1:1) или н-гексан - этилацетат (1:1).Для обработки хроматограмм можно использовать те же реактивы, что и при проведении цветных реакций на сапонины.
Тритерпеновые сапонины, производные олеаноловой кислоты из аралии маньчжурской (аралозиды) и сахарной свеклы предложено определять методом ВЭТСХ на пластинах «Силуфол», «Армсорб» и «Сорбфил» при температуре 20-250С.
В качестве проявителей используют 25% спиртовый раствор кислоты фосфорновольфрамовой (малиновые пятна сапонинов на белом фоне) и 10% спиртовый раствор кислоты фосфорномолибденовой (темно-синие пятна сапонинов на желтом фоне).
Сканирование зон проводят денситометром «Shimadzu CS-9000» при длине волны 675 нм.
Хроматографирование осуществляют в системах:
I – хлороформ – метанол - вода (30:17:3);
II – н-бутанол – этанол - аммиак (7:2:5);
III – БУВ 4:1:5 (верхний слой).
Для сапонинов сахарной свеклы – бензол - этилацетат 1:1.
Для сравнения наносят раствор СО аралозидов с концентрацией 1 мг/мл.
Хроматограммы, полученные при сканировании, позволяют определять также соотношение индивидуальных сапонинов в анализируемых образцах [43-48].
Качественный анализ сердечных гликозидов возможен с применением метода хроматографии на бумаге, пропитанной формамидом, либо в тонком слое сорбента (тальк, силикагель, кизельгур). В этом случае применение систем бензол - хлороформ (от 9:1 до 3:7), толуол - н-бутанол (от 9:1 до 1:1), этилацетат - бензол - вода (84:16:50), хлороформ - бензол - н-бутанол (78:12:5) или просто хлороформа в качестве подвижной фазы позволяет достичь четкого разделения отдельных групп гликозидов.
Для обнаружения гликозидов на хроматограммах применяют реактивы, вызывающие флуоресценцию или окрашивание. Наиболее широко применяют смесь кислоты трихлоруксусной 25% и 3% раствора хлорамина в этиловом спирте (15:1). В УФ свете производные дигитоксигенина дают четкую золотисто-желтую флуоресценцию; гитоксигенина - голубую; дигоксигенина - стальную.
Фенольные гликозиды в лекарственном растительном сырье могут быть идентифицированы хроматографией в тонком слое сорбента или на бумаге. Наиболее применимыми элюентными системами в этом случае могут считаться: н-бутанол - уксусная кислота - вода (4:1:5), н-бутанол - уксусная кислота - вода - ксилол (6:2:3:4), хлороформ - метанол (8:2) и кислота уксусная 2-15%.
Хроматографический метод в тонком слое сорбента считается наиболее подходящим для разделения и анализа производных флороглюцина. Оптимальными сорбентами в этом случае могут считаться: силикагель, диоксид кремния, полиамид, оксид алюминия. В качестве подвижной фазы рекомендуют: петролейный эфир - хлороформ (1:1), бензол - хлороформ (1:1), циклогексан - хлороформ (1:1), гексан - петролейный эфир (1:1) с 5 % спирта этилового.
Однако, основным методом качественного анализа и установления подлинности гликозидсодержащих субстанций является метод высокоэффективной жидкостной хромато-графии. К настоящему времени еще не описано ни одной универсальной ВЭЖХ системы для анализа гликозидов, хотя, по мнению ряда авторов, оптимальной может быть признана: Novapak RP18 с подвижной фазой CH3CN - H2O при градиентном элюировании от 5:95 до70:30 за 30 мин и использовании УФ детектора (254 нм) [49].
На той же колонке предложено анализировать тритерпеновые гликозиды, используя в качестве подвижных фаз: 0.1M раствор аммония формиата в спирте метиловом 40% с увеличением концентрации формиата в спирте от 0.1 до 1.0 M и 4 мM раствор тетра-N-бутиламмония гидросульфата в спирте метиловом 20%. В работах использовался УФ детектор при 270 нм [50,51]. Различные системы для анализа карденолидов и буфадиенолидов были предложены в работе [52]. Исследование карденолидов проводились в системе: Lichrospher 100-RP18, подвижная фаза – ацетонитрил-вода (от 3:7 до 6:4 за 30 мин), УФ детектор (230 нм). Элюентом для буфадиенолидов служил водный метанол (от 10 до 60% за 40 мин), детектирование проводилось при 280 нм.
Сердечные гликозиды предложено разделять на колонках с Lichrospher 100-RP18, Nucleosil 100-3 RP18 и Nucleosil 120-7-C6H5, используя градиентное элюирование водно-метанольными смесями от 5 до 95% с добавлением 0.1% кислоты трифторуксусной или без таковой проводя анализ при 220 нм [53]. Линейный градиент концентрации ацетонитрила (20-80%) в воде был использован при анализе сердечных гликозидов клеток крови на колонке µBondapak C18 с фотодиодной матрицей [54].
Для анализа фенольных гликозидов не существует строго селективных хроматографических систем. Предлагаемые в работах [55-57] системы (Diol-120 или mBondapak C18 –колонка и градиентное элюирование 15-85% водным метанолом с использованием УФ-детектора при 276 нм или рефрактометра; LiChrospher-100 RP18 колонка при градиентном элюировании смесями А(2% кислота уксусная) и В(уксусная кислота – ацетонитрил – вода 2:20:78) при увеличении содержания В в А от 20 до 60% за 40 мин) также применимы к анализу любых полифенольных соединений.
Убедительные результаты были получены японскими учеными в анализе флороглюцидов на 5C18-MS колонке с подвижной фазой метанол - 0.1% H3PO4 35:65 (УФ детектор 254 нм) [58]. Достаточно эффективным оказалось разделение смеси флороглюцидов на колонке Nucleosil C18 AB, элюентом служила смесь ацетонитрила и орто-фосфорной кислоты (98.5:1.5) при анализе на фотодиодной матрице [59].
Ниже приведены методики определения различных по природе гликозидов.
Описанные методы количественной оценки их содержания включают стадию извлечения гликозидов из сырья, совмещая с гидролизом их или без гидролиза, с последующим спектрофотометрическим определением оптических плотностей полученных извлечений при разных длинах волн, в зависимости от природы агликона [11,32,43-46].
Сапонины. Метод 1. Около 2 г измельченного сырья (точная навеска) помещают в колбу вместимостью 100 мл, прибавляют 20 мл 3% ацетонового раствора кислоты азотной и настаивают в течение 1 ч при постоянном перемешивании. Извлечение отфильтровывают в цилиндр вместимостью 100 мл. В колбу с сырьем приливают еще 20 мл ацетона, которым одновременно смывают порошок с фильтра, и кипятят с обратным холодильником на водяной бане в течение 30 мин. Аналогичную экстракцию горячим ацетоном повторяют еще 2 раза. Объединенные извлечения отфильтровывают через тот же фильтр в тот же цилиндр. Жидкость из цилиндра выливают в стакан вместимостью 200 мл. Цилиндр ополаскивают 10 мл спирта этилового, который затем выливают в тот же стакан. Далее по каплям при интенсивном помешивании добавляют концентрированный раствор аммиака до появления обильного светло-желтого творожистого осадка (рН 8.3-8.6 устанавливают по порозовению влажной фенолфталеиновой бумаги).
Осадок отделяют на воронке Бюхнера, стакан и фильтр с осадком промывают 30 мл ацетона в 2-3 приема. Осадок с фильтром переносят в стакан, в котором проводилось осаждение, и растворяют в 50 мл воды очищенной.
Полученный раствор количественно переносят в мерную колбу вместимостью 100 мл. Фильтр промывают небольшими порциями воды очищенной, присоединяя их к основному раствору. Доводят объем раствора водой очищенной до метки.
[30 мл полученного раствора помещают в мерную колбу вместимостью 100 мл и доводят объем раствора водой очищенной до метки.] *
Измеряют оптическую плотность полученного раствора на спектрофотометре при длине волны 258 нм в кювете с толщиной слоя 10 мм, используя в качестве раствора сравнения воду очищенную.
Содержание сапонинов в абсолютно сухом сырье, в пересчете на кислоту глицирризиновую в процентах (Х) вычисляют по формуле:
|
11000 . m . [30] . (100 - W)
где D - оптическая плотность испытуемого раствора при длине волны 258 нм;
11000 – удельный показатель поглощения раствора кислоты глицирризиновой при длине волны 258 нм;
822 – молекулярная масса кислоты глицирризиновой;
m – масса навески сырья, в граммах;
W – потеря в массе при высушивании сырья, в процентах.
* При необходимости испытуемый раствор разбавляют [7].
Метод 2. Около 2 г (точная навеска) измельченного сырья помещают в плоскодонную колбу вместимостью 100 мл, прибавляют 50 мл спирта этилового 95%, нагревают и перемешивают на магнитной мешалке в течение 1 часа с момента закипания растворителя. Затем охлаждают, фильтруют.
10 мл фильтрата переносят в мерную колбу вместимостью 50 мл, объем раствора доводят до метки спиртом этиловым 95%, перемешивают.
5 мл раствора переносят в пробирку с притертой пробкой, прибавляют 5 мл 1% п-диметиламинобензальдегида в 4 М спиртовом растворе кислоты хлороводородной.
Пробирку закрывают пробкой и нагревают в ультра-термостате при температуре 58±0.50С в течение 2 часов. Затем раствор охлаждают до комнатной температуры и измеряют оптическую плотность при длине волны 518 нм в кювете с толщиной слоя 10 мм. В качестве раствора сравнения используют смесь 5 мл рабочего раствора и 5 мл 4 М спиртового раствора кислоты хлороводородной. Смесь выдерживают в термостате при 58±0.50С.
Содержание фурастаноловых гликозидов в абсолютно сухом сырье (Х) в процентах вычисляют по формуле:
|
m . 10 . (100 - W)
где С – количество CoCl2 найденное по калибровочному графику, в граммах;
0.0101 – коэффициент пересчета концентрации CoCl2;
m – масса навески сырья, в граммах;
W – потеря в массе при высушивании сырья, в процентах.
Примечания. Построение калибровочного графи-ка по растворам CoCl2. 0.1 г CoCl2, высушенного при температуре 130-1350С растворяют в 10 мл воды очищенной и готовят 5 растворов методом разбавления.
Гликозиды тритерпеновые. Около 2 г (точная навеска) измельченного сырья помещают в круглодонную колбу вместимостью 100 мл, прибавляют 50 мл спирта этилового 70% и нагревают с обратным холодильником в течение 2 часов. Затем извлечение охлаждают, отфильтровывают в мерную колбу вместимостью 100 мл, доводят объем раствора спиртом этиловым 70% до метки и перемешивают.
[Около 0.1 г субстанции препарата растворяют в 100 мл спирта этилового 95%]. (*)
10 мл полученного раствора переносят в мерную колбу вместимостью 100 мл и доводят объем спиртом этиловым 70% до метки.
В мерную колбу вместимостью 10 мл помещают 2 мл рабочего раствора, 5 мл свежеприготовленного 0.7% раствора ванилина в кислоте серной 65%, выдерживают в термостате 1 час при 600С. Содержимое колбы охлаждают в ледяной воде в течение 10 минут.
Измеряют оптическую плотность полученного раствора на спектрофотометре при длине волны 560 нм в кювете с толщиной слоя 10 мм, используя в качестве раствора сравнения прогретый в течение 1 ч раствор ванилина.
Содержание тритерпеновых гликозидов в абсолютно сухом сырье в процентах (Х) определяют в пересчете на СО дазиантозида А или другого сапонина по формуле:
|
Е . m . (100 - W)
где D - оптическая плотность испытуемого раствора при длине волны 560 нм;
Е=200 – удельное поглощение раствора дазиантозида А с ванилином и кислотой серной при длине волны 560 нм;
W – потеря в массе при высушивании сырья, в процентах;
m – масса навески сырья, в граммах [44].
* При низком содержании тритерпеновых гликозидов увеличивают навеску сырья или субстанции.
Методика определения суммы тритерпеновых гликози-дов в субстанции из астрагала. Около 0.1 г субстанции растворяют в 100 мл спирта этилового 96%. [10 мл полученного раствора переносят в мерную колбу вместимостью 100 мл и доводят спиртом этиловым 96% до метки]. Готовят спиртовый раствор с содержанием дазиантозида А 0.1 мг/мл. В 3 колбы вместимостью 10 мл помещают по 2 мл рабочего раствора, а в 2 колбы - по 2 мл раствора дазиантозида А и упаривают досуха в сушильном шкафу при 1000С. В каждую из колб добавляют по 5 мл свежеприготовленного 0.7% раствора ванилина в кислоте серной 65% и выдерживают в термостате 1 ч при 600С. Содержимое колб охлаждают в ледяной воде в течение 10 мин. В качестве раствора сравнения используют прогретый в течение 1 ч раствор ванилина.
Оптическую плотность измеряют на спектрофотометре при длине волны 560 нм в кювете с толщиной слоя 10 мм.
Содержание суммы тритерпеновых гликозидов определяют в пересчете на дазиантозид А путем сравнения оптических плотностей и навесок с учетом потерь в массе при высушивании [44].
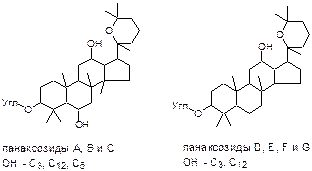 |
Женьшень – Panax ginseng C.A..Mey. – тонизирующее средство – содержит сумму сапонинов, называемых панаксозидами или гинзенозидами 2 типов:
В составе 2-х углеводных цепей, одна из которых находится у С3, может быть от 3 до 6-ти молекул глюкозы, рамнозы, арабинозы и ксилозы.
Панаксозиды относят к гликозидам стероидной структуры, несущим при С17 спирокетальную группировку из семи углеродных атомов, и одновременно к тритерпенам по общему количеству углеродных атомов (30) и по количеству и размещению СН3-групп.
Ниже приведена методика количественного определения суммы гликозидов женьшеня.
1385.8 мг порошка растертых таблеток помещают в коническую колбу вместимостью 50 мл, прибавляют 20 мл смеси спирт метиловый – вода очищенная (1:1), перемешивают на магнитной мешалке в течение 10 мин, затем выдерживают в ультразвуковой бане в течение 5 мин, количественно переносят суспензию в центрифужную пробирку, центрифугируют при 5000 об/мин в течение 5 мин. Надосадочную жидкость отделяют и помещают в круглодонную колбу вместимостью 250 мл. Остаток в центрифужной пробирке еще 2 раза экстрагируют по вышеуказанной методике, экстракты помещают в ту же круглодонную колбу и упаривают растворитель до объема 10 мл в вакуумном роторном испарителе. Остаток переносят в мерную колбу вместимостью 20 мл, круглодонную колбу дважды обмывают (по 3 мл) водой очищенной, промывные растворы помещают в ту же мерную колбу, доводят объем раствора водой очищенной до метки, перемешивают, центрифугируют, надосадочную жидкость отделяют.
Для удаления из испытуемого раствора неопределяемых балластных веществ используют картридж для твердофазной экстракции “Extrolut 20” или аналогичный. В картридж помещают 20 мл воды очищенной, насыщенной спиртом н-бутиловым, открывают кран, заполняют колонку с сорбентом до 1/3 объема и закрывают кран. 10.0 мл надосадочной жидкости помещают в картридж, выдерживают в течение 15 мин и элюируют 80 мл воды очищенной, насыщенной спиртом н-бутиловым. Элюат собирают по каплям в коническую колбу вместимостью 100 мл, затем фильтруют через слой натрия сульфата безводного в круглодонную колбу вместимостью 500 мл и упаривают при температуре не выше 400С. Сухой остаток растворяют в 5.0 мл воды очищенной и фильтруют через мембранный фильтр с размером пор 0.45 мкм (испытуемый раствор).
По 20 мкл испытуемого раствора и раствора СО экстракта женьшеня попеременно хроматографируют на жидкостном хроматографе с УФ-детектором, получая не менее 5 хромато-грамм для каждого из растворов в следующих условиях:
§ колонка, размером 125х4.5 мм, заполненная сорбентом Lichrospher 100 RP18, с размером частиц 5 мкм;
§ подвижная фаза А: вода очищенная, дегазированная;
§ подвижная фаза В: ацетонитрил;
§ схема градиентного элюирования
| Время, мин | |||||||
| А,% | |||||||
| В,% |
§ скорость подвижной фазы 1.5 мл/мин;
§ детектирование при длине волны 203 нм;
§ температура колонки 400С.
Содержание суммы гинзенозидов (Х) в одной таблетке, в миллиграммах, вычисляют по формуле:
|
SS0 . m1 . 100 . 10 . 20 . 5
где SS1 – среднее значение суммы площадей пиков гинзенози-дов, вычисленное из хроматограмм испытуемого раствора;
SS0 – среднее значение суммы площадей пиков гинзенози-дов, вычисленное из хроматограмм раствора СО экстракта женьшеня;
m0 – масса навески СО экстракта женьшеня, в миллиграммах;
m1 – масса навески препарата, в миллиграммах;
Р – содержание гинзенозидов в СО экстракта женьшеня, в процентах;
b – средняя масса таблетки, в миллиграммах.
Примечания. Приготовление раствора СО экстракта женьшеня. 327.1 мг (точная навеска) экстракта женьшеня, содержащего 4% гинзенозидов, помещают в мерную колбу вместимостью 20 мл, прибавляют 18 мл воды очищенной, выдерживают в ультразвуковой бане в течение 15 мин, доводят объем раствора водой очищенной до метки, перемешивают, центрифугируют.
10.0 мл полученного раствора помещают в картридж для твердофазной экстракции “Extrolut 20” или аналогичный и обрабатывают по методике, описанной в приготовлении испытуемого раствора.
b-ситостерол. Точную навеску сырья (около 2 г) экстрагируют в аппарате Сокслета 50 мл неполярного растворителя в течение 2-3 часов, фильтруют в мерную колбу вместимостью 100 мл. [навеску препарата растворяют в н-гексане](*). Доводят объем раствора тем же растворителем до метки, перемешивают на ультразвуковой бане в течение 20 мин, охлаждают до комнатной температуры и центрифугируют (испытуемый раствор).
По 10 мкл испытуемого раствора и раствора СО b-ситостерола попеременно хроматографируют на жидкостном хроматографе с УФ - детектором, получая не менее 5 хромато-грамм для каждого из растворов в следующих условиях:
§ колонка [250x2.6 мм], заполненная сорбентом Силика А, с размером частиц 5 мкм, или аналогичная;
§ подвижная фаза: н-гексан - 2-пропанол - спирт метиловый (96:3.5:0.5), дегазированная любым удобным способом;
§ скорость подвижной фазы 1.0 мл/мин;
§ детектирование при длине волны 210 нм.
Содержание b-ситостерола (X) в миллиграммах, вычисляют по формуле:
|
S0 . m1 . 20 . 10 . 100
где S1 - среднее значение площадей пиков b-ситостерола, вычисленное из хроматограмм испытуемого раствора;
S0 - среднее значение площадей пиков b-ситостерола, вычисленное из хроматограмм раствора СО b-ситостерола;
m0 - масса навески СО b-ситостерола, в миллиграммах;
m1 - масса навески препарата, в миллиграммах;
b - средняя масса содержимого капсулы, в миллиграммах;
Р - содержание b-ситостерола в СО b-ситостерола, в процентах.
Результаты анализа считаются достоверными, если выполняются требования теста "Проверка пригодности хроматографической системы".
Примечания. Приготовление раствора СО b-ситостерола. Около 20.0 мг (точная навеска) b-ситостерола помещают в мерную колбу вмести-мостью 20 мл, растворяют в н-гексане, доводят объем раствора этим же растворителем до метки и перемешивают.
1.0 мл полученного раствора помещают в мерную колбу вместимостью 10 мл, доводят объем раствора н-гексаном до метки и перемешивают. Раствор используют свежеприготовленным.
Проверка пригодности хроматографической системы. Хроматографическая система считается пригодной, если выполняются следующие условия:
§ относительное стандартное отклонение, рас-считанное для площади пика b-ситостерола на хроматограммах раствора СО b-ситостерола должно быть не более 2.0% (ГФ XI, вып. 1, с. 199);
§ относительное стандартное отклонение, рас-считанное для времени выхода пика b-ситостерола на хроматограммах раствора (СО b-ситостерола должно быть не более 2.0% (ГФХ1,вып. 1,с. 199).
Гликозиды сердечные. Метод 1. 10 мл препарата помещают в мерную колбу вместимостью 25 мл, прибавляют спирт этиловый 96% и доводят объем раствора этим же растворителем до метки, перемешивают.
К 5 мл полученного раствора прибавляют 4 мл спирта этилового 96%, 5 мл раствора натрия пикрата, на 15 минут оставляют в темном месте, после этого измеряют оптическую плотность полученного раствора на спектрофотометре при длине волны 495 нм в кювете с толщиной слоя 10 мм, используя в качестве раствора сравнения раствор, состоящий из 5 мл спирта этилового 96% и 5 мл раствора натрия пикрата.
Параллельно измеряют плотность раствора СО коргликона.
Содержа
|
из
5.00
|
Обсуждение в статье: Общие методы получения антрахинонов |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

