 |
Главная |
АМИНОКИСЛОТЫ, БЕЛКОВЫЕ КОМПЛЕКСЫ, БЕТАИНЫ
|
из
5.00
|
Это вещества первичного синтеза, они присутствуют во всех органах всех растений.
В зависимости от взаимного расположения амино- и карбоксигрупп различают a,b,g,s и др. аминокислоты, из них наиболее распространены a, b и g. a-аминокислоты L-конфигурации – важнейшие составные части пептидов и белков. Кроме того, в растениях могут быть одноосновные диамино- и двухосновные моноаминокислоты.
Для качественного и количественного определения аминокислот используют гель-фильтрацию, бумажную, тонкослойную, ионообменную и ВЭЖХ хроматографию (аминокислотный анализатор), а также электрофорез.
Эти же методы применимы и при установлении аминокислотной последовательности в пептидах и белках.
 |
Все аминокислоты, при низком значении рН, проявляют свойства кислот, при высоком – оснований, а в изоэлектрической точке – как цвиттер ион. В связи с этим аминокислоты являются амфолитами.
Все аминокислоты растворимы в кислых и щелочных растворах из-за образования солей (около изоэлектрической точки растворимость ничтожно мала), в спиртах, водно-органических растворителях.
Аминокислоты с циклическими фрагментами (фенилаланин, гистидин, триптофан, пролин и др.) отличает высокое отрицательное значение удельного вращения.
Для качественного обнаружения многообразия аминокислот нет строго специфичной реакции.
Пептиды бывают линейные и циклические, гомо- и гетеро-. В растениях чаще всего, встречаются олигопептиды.
Выделение:
Измельченное растительное сырье заливают спиртом этиловым 50%, нагревают на кипящей водяной бане в течение 30 мин, фильтруют. Для анализа используют 1-3 мл извлечения.
Качественный анализ [12]:
q 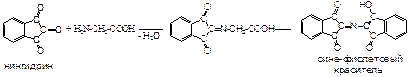
Добавляют 1-3 капли 0.1-1% спиртового раствора нингидрина, появляется различное, от желтого до фиолетового, окрашивание (аминокислоты, аминосахара, алкалоиды, первичные и вторичные амины); фиолетовое окрашивание различных оттенков специфично для a-аминокислот.
q Добавляют 1-2 мл раствора натрия нитрита в кислоте соляной или уксусной, появляется различное окрашивание или окрашивание с выделением паров азота (аминокислоты с первичной и вторичной аминогруппой, алкалоиды, амины).
| |
q Добавляют 1-2 мг резорцина и 5 капель кислоты серной концентрированной, нагревают до появления зелено-коричневого окрашивания. Затем добавляют 5 мл воды и 5 мл раствора аммиака, появляется красно-фиолетовое окрашивание, иногда с зеленой флюоресценцией (аминокислоты, амины, алкалоиды, аминосахара).
q Добавляют 1-3 мл 10% раствора кислоты хлороводород-ной, 1-3 капли 0.1 М раствора натрия нитрита, перемешивают, затем добавляют 1-3 мл щелочного раствора b-нафтола, появ-ляется вишнево-красное окрашивание или выпадает осадок от оранжевого до красного цвета (аминокислоты ароматические, амины ароматические).
q Добавляют 2-3 капли реактива Фелинга (раствор I - 34.66 г меди сульфата растворяют в воде, подкисленной 2-3 каплями кислоты серной разведенной и доводят объем водой до 500 мл. Раствор II - 173 г сегнетовой соли и 50 г натра едкого растворяют в 400 мл воды и после охлаждения доводят объем водой до 500 мл. Реактивом служит смесь равных объемов растворов I и II, 5 мл реактива Фелинга разбавляют 5 мл воды, нагревают до кипения), появляется зеленое или бурое окрашивание (аминокислоты одно- и двухосновные).
q Добавляют по каплям при встряхивании кислоту уксус-ную концентрированную или трихлоруксусную, наблюдается выпадение осадка, реже мути или хлопьев (белковые вещества, кроме желатина). При дальнейшем добавлении кислоты осадок белка растворяется.
q Кислый раствор нагревают до кипения, добавляют 1-2 капли раствора аммония сульфата, белок свертывается.
q Биуретовая реакция. Добавляют 1-2 мл раствора натра едкого концентрированного и 1 мл раствора меди сульфата, наблюдается яркое сине-фиолетовое окрашивание (белки, пептиды, белковые комплексы).
q Реакция Миллона. Добавляют 1-2 мл азотно-ртутного реактива (растворяют при нагревании 2 г металлической ртути в 3 мл кислоты азотной концентрированной, разбавляют водой до 10 мл), нагревают смесь на кипящей водяной бане, выпадает сначала белый осадок, затем при нагревании - кирпично-красный (белковые вещества, тирозин, триптофан, п-оксифенилаланин). Желатин окрашивания не дает.
q Ксантопротеиновая реакция. Добавляют 1 мл кислоты азотной концентрированной, появляется муть или белый осадок, цвет которого при нагревании меняется на ярко-желтый (ароматические аминокислоты, фенилаланин, тирозин, триптофан).
q Добавляют двойной объем концентрированного раство-ра натрия гидроксида, кипятят 2-3 минуты. Выпадает осадок, который при дальнейшем нагревании растворяется, иногда выделяется аммиак. К горячему раствору добавляют 1 мл 10% раствора свинца ацетата или нитрата. При нагревании образуется сначала белый, затем коричневый или черный осадок (серусодержащие аминокислоты и белки).
q Мурексидная проба. Добавляют 1-2 мл концентриро-ванной перекиси водорода и 1-2 мл кислоты хлороводородной, образуется осадок (ксантины, аминокислоты, алкалоиды):

Хроматографический анализ:
При наличии СО аминокислот возможно проведение качественного хроматографического анализа аминокислот и бетаинов методом одномерной хроматографии на бумаге или в тонком слое в системах: н-бутанол – уксусная кислота – вода (40:12.5:29) или (4:1:5), используя в качестве проявителя нингидриновый реактив.
Более точные результаты в качественном анализе аминокислот получают использованием метода ВЭЖХ [22]. Характеристика наиболее унифицированных, оптимальных методик приведена в таблице:
| НФ | ПФ | детектор |
| Inertsil ODS-2 | CH3OH/ 10mM CH3COONa (pH=4.5 – H3PO4) – 0.4mM (CH3COO)2Cu – 6.4mM 1-гептансульфонат натрия (22:78) | УФ (230 нм) |
| Inertsil ODS-2 | А: CH3CN ; В: Н2О А/В от 2:8 до 4:6 за 25 мин | УФ (254 нм) |
| Inertsil ODS-С8 | A: CH3CN – 0.1M CH3COONH4 (5:95) B: CH3CN – 0.1M CH3COONH4 (60:40) A/B от 100:0 до 0:100 за 14 мин | УФ (254 нм) |
| Inertsil ODS-3V | A: CH3CN B: 0.1M NH4H2PO4 A/B: от 10:90 до 40:60 за 15 мин | УФ (254 нм) |
| Inertsil CN-3 | 20mM калий-фосфатный буфер (pH=4.0) | УФ (210 нм) |
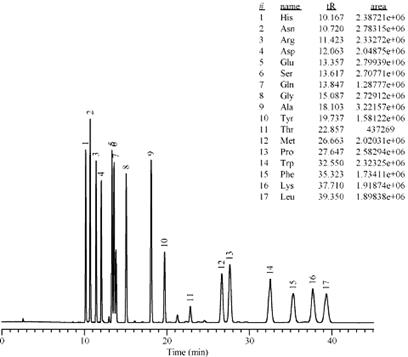
Количественное определение содержания аминокислот проводят одновременно с качественным анализом методом ВЭЖХ в присутствии СО или методом фотометрии [23-28]. Достаточно точным является метод, описанный ниже, с использованием СО:
Около 1 г сырья (точная навеска) заливают 20 мл воды очищенной, настаивают при комнатной температуре в течение 24 часов, фильтруют.
К 10 мл извлечения добавляют 10 мл нингидринового реактива, нагревают в течение 15 минут на водяной бане при температуре 80-850С, охлаждают, отмечают цвет полученного раствора и измеряют его оптическую плотность на фотоэлектро-колориметре или спектрофотометре при длине волны 540 нм в кювете с толщиной слоя 10 мм (светофильтр №9). В качестве контрольного раствора используют воду очищенную с нингидриновым реактивом. По калибровочной кривой определяют содержание аминокислот в анализируемом сырье.
|
2 . m . 10 . [(100 - W)]
где С – концентрация аминокислот, найденная по калибро-вочному графику;
m - масса навески сырья в граммах;
W - потеря в массе при высушивании сырья в процентах.
Примечания. Приготовление нингидринового ре-актива. 4 г нингидрина, 76 г олова хлорида, 150 мл диоксана и 50 мл ацетатного буфера (рН=5.0) тщательно перемешивают.
Построение калибровочного графика. Для построения калибровочного графика используют доминирующую в составе сырья аминокислоту или смесь равных количеств нескольких аминокислот в мерной колбе на 100 мл. Цвет должен совпадать по окраске анализируемого образца с нингидриновым реактивом.
Отбирают 0.1, 0.3, 0.5, 0.7 и т.д. мл раствора аминокислот с нингидриновым реактивом в мерные колбы на 10 мл, доводят объем растворов до метки водой очищенной и измеряют оптическую плотность на фотоэлектроколориметре при длине волны 540 нм в кювете с толщиной слоя 10 мм (светофильтр №9).
Бетаины – внутренние соли N–триалкилзамещенных аминокислот, являются спутниками амино- и оксосоединений, хорошо растворимы в воде и водно-спиртовых растворах.
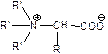 |
Также как аминокислоты, они существуют в виде биполярных ионов, растворимы в растворах щелочей и кислот.
Превращение многих аминокислот в бетаины – процесс, характерный для азотистого обмена многих видов растений, особенно много бетаинов в видах эхинацеи. В растениях обнаружены бетаин гликокола - бетаин, пролина – стахидрин, триптофана – гипофорин, орнитина – миокинин, никотиновой кислоты – триогонемин и др.
Для разделения и анализа бетаин-содержащих субстанций чаще всего используется метод ВЭЖХ на колонках Supelcosil LC-SCX (5 мкм) или подобных, используя в качестве подвижной фазы 22 mМ раствор холина в 900 мл ацетонитрила и 100 мл воды (УФ детектор, 254 нм).
Ниже описан метод количественного определения бетаинов в таблетках сухого экстракта травы эхинацеи.
Количественное определение бетаинов:
Около 0.5 г (точная навеска) порошка растёртых таблеток помещают в мерную колбу вместимостью 50 мл, прибавляют 30 мл воды очищенной, перемешивают на ультразвуковой бане в течение 15 мин, доводят объем раствора водой очищенной до метки, перемешивают и фильтруют. 5 мл фильтрата пропускают через колонку, заполненную кислотой сульфоновой, затем промывают колонку 2 мл воды очищенной и элюируют 10 мл 10% раствора аммиака, выпаривают под вакуумом при темпе-ратуре 500С досуха. Полученный остаток растворяют в 5 мл подвижной фазы и фильтруют перед хроматографированием (испытуемый раствор).
По 20 мкл испытуемого раствора и раствора СО бетаина попеременно хроматографируют на жидкостном хроматографе с УФ-детектором, получая не менее 5 хроматограмм для каждого из растворов, в следующих условиях:
§ колонка, размером 250x4.0 мм, заполненная сорбентом «Lichrospher-100 RP18», (5 мкм), или аналогичная;
§ подвижная фаза: дегазированная любым удобным способом;
§ скорость подвижной фазы 1.0 мл/мин;
§ детектирование при длине волны 192 нм;
§ температура колонки - 400С;
§ время хроматографирования 45 мин.
Содержание бетаина (X), в одной таблетке, в миллиграммах, вычисляют по формуле:
|
S0 . 50 . 5 . m1 . 5 . 100
где S1 - среднее значение площадей пиков бетаина, вычислен-ное из хроматограмм испытуемого раствора;
S0 - среднее значение площадей пиков бетаина, вычисленное из хроматограмм раствора СО бетаина;
m0 - масса навески СО бетаина, в миллиграммах;
m1 - масса навески препарата, в граммах;
b - средняя масса одной таблетки, в граммах;
Р - содержание бетаина в СО бетаина, в процентах.
Примечания. Приготовление раствора СО бета-ина.Около 5 мг (точная навеска) СО бетаина помещают в мерную колбу вместимостью 50 мл, прибавляют 30 мл воды очищенной, перемешивают на ультразвуковой бане в течение 15 мин, доводят объем раствора водой очищенной до метки и перемешивают.
10 мл полученного раствора пропускают через экстракционную колонку, заполненную кислотой сульфоновой, затем промывают колонку 2 мл воды очищенной. Полученный раствор смешивают с 10 мл 10% раствора аммиака, выпаривают под вакуумом при 500С досуха. Остаток растворяют в 5 мл подвиж-ной фазы. Раствор используют свежеприготов-ленным.
Приготовление подвижной фазы.К 0.3 г натрия додецилсульфата прибавляют 700 мл воды очищенной, 300 мл среды растворения и перемешивают.
Приготовление среды растворения.1,0 г натрия додецилсульфата помещают в колбу, прибав-ляют 900 мл воды очищенной, 100 мл ацетонитрила, 1 мл 85% кислоты фосфорной, 2.5 мл триэтиламина и перемешивают.
|
из
5.00
|
Обсуждение в статье: АМИНОКИСЛОТЫ, БЕЛКОВЫЕ КОМПЛЕКСЫ, БЕТАИНЫ |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

