 |
Главная |
Винилгалогениды. Соединения с пониженной подвижностью атома галогена: винилхлорид и хлоропрен. Способы получения, химические свойства и применение
|
из
5.00
|
Винилхлори́д - бесцветный газ со слабым сладковатым запахом, имеющий формулу C2H3Cl и представляющий собой простейшее хлорпроизводное этилена.
Строение молекулы. В молекуле винилхлорида связь C-Cl более короткая и более прочная, чем аналогичная связь в молекуле хлорэтана.
В таблице представлены сравнительные значения длин и энергии связей, а также дипольных моментов в молекуле винилхлорида и хлорэтана:
| Соединение | Энергия связи C-Cl кДж/моль | Длина связи C-Cl, нм | Дипольный момент |
| CH2=CHCl | 374,89 | 0,169 | 4,80 |
| CH3-CH2Cl | 336,39 | 0,179 | 6,66 |
Укорочение длины связи обусловлено p,π-сопряжением π-орбиталей кратной связи с неподелённой электронной парой атома хлора и образованием единой делокализованной системы π-электронов:
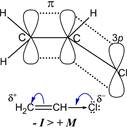
Рис. 19.19. Электронная формула винилхлорида
Способы получения. В настоящее время существуют три основных способа получения винилхлорида, реализованные в промышленных масштабах:
1. Метод каталитического гидрохлорирования ацетилена:
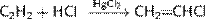
2. Комбинированный метод на основе этилена и ацетилена. Метод включает:
а) реакцию хлорирования этилена до дихлорэтана;
б) термическое разложение дихлорэтана с образованием винилхлорида;
в) реакцию гидрохлорирования ацетилена до винилхлорида с использованием хлороводорода со стадии термического разложения дихлорэтана:

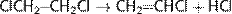

Метод позволил:
- заменить половину ацетилена на более дешёвый этилен;
- утилизировать хлороводород, тем самым довести почти до 100 % полезное использование хлора.
3. Сбалансированный по хлору метод на основе этилена. Метод включает следующие реакции:
а) хлорирование этилена:
 ;
;
б) термическое дегидрохлорирование дихлорэтана:
 ;
;
в) окислительное хлорирование этилена:
 .
.
Хлороводород, получаемый в результате дегидрохлорирования дихлорэтана, вступает в реакцию с кислородом и этиленом в присутствии медного катализатора, образуя дихлорэтан и тем самым уменьшая расход элементарного хлора, используемого для прямого хлорирования этилена.
Химические свойства. Химические свойства винилхлорида определяются как наличием двойной связи, так и атома хлора.
1. Подобно алкенам, винилхлорид вступает в реакции присоединения по кратной связи.
2. В отличие от галогеналкенов винилгалогениды обладают низкой реакционной способностью в обычных реакциях нуклеофильного замещения и элиминирования. Винилгалогениды не удается превратить при действии обычных нуклеофильных реагентов в спирт, простые и сложныеэфиры, амины и т.д.
3. Под действием оснований, особенно при нагревании, вместо замещения протекают реакции полимеризации.
В отсутствии кислорода и света при обычных условиях чистый винилхлорид может существовать достаточно долго, не претерпевая каких-либо изменений; однако появление свободных радикалов, вызываемое как фотохимически, так и термохимически, приводит к его быстрой полимеризации:

Рис. 19.19. Схема реакции полимеризации винилхлорида
Механизм полимеризации носит радикальный характер и схематично может быть представлен следующим образом:
Хлоропрен (2-хлор-1,3-бутадиен), СН2=ССl-СН=СН2 - бесцветная жидкость,
tкип 59,4 °C.
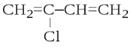
Рис.19.20. Структурная формула хлоропрена
Способоы получения.Из многочисленныхспособовполученияхлоропрена только два доступны для промышленности: ацетиленовый и бутадиеновый.
1. Ацетиленовый. Получение хлоропрена из ацетилена протекает в две стадии:

1-я стадия - димеризация ацетилена в винилацетилен в присутствии катализатора — водного раствора CuCl2, NH4C1 и HCl при 80–90°С:
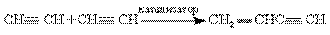
2-я стадия - гидрохлорирование винилацетилена в хлоропрен осуществляют в присутствии водного раствора CuCl2, HC1 и FеС12 при 45°С:

2. Бутадиеновый. Экономически более выгодным и эффективным является метод синтеза на основе бутадиена. Синтез хлоропрена протекает через промежуточное образование 3,4-дихлор-1-бутена и 1,4-дихлор-2-бутена:
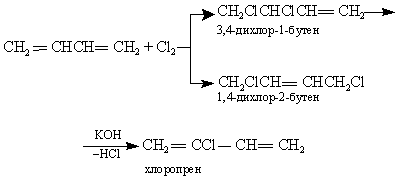
Рис. 19.20. Бутадиеновый метод синтеза хлоропрена
Химические свойства. Хлоропрен обладает химическими свойствами диеновых углеводородов.
1. Наличие атома хлора (С1) и системы сопряженных двойных связей значительно повышает активность хлоропрена в радикальных реакциях.
2. Атом хлора (С1) химически мало активен.
Полимеризация хлоропрена протекает по радикальному механизму. При комнатной температуре хлоропрен полимеризуется спонтанно с образованием каучукоподобного и губчатого полимеров.
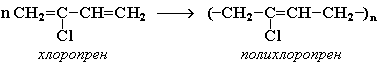
Полихлоропреновые каучуки (наирит, неопрен) –
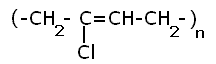
один из наиболее давно известных видов синтетических каучуков – разработаны компанией «Дюпон» в 1930-х. Обладают высокой масло-, бензо-, озоностойкостью.
Полихлоропреновый каучук Байпрен применяется в производстве конвеерных лент, приводных ремней, рукавов, шлангов, водолазных костюмов, электроизоляционных материалов, технических пластин. Из полихлоропренового каучука производят также оболочки проводов и кабелей, защитные покрытия.
|
из
5.00
|
Обсуждение в статье: Винилгалогениды. Соединения с пониженной подвижностью атома галогена: винилхлорид и хлоропрен. Способы получения, химические свойства и применение |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

