 |
Главная |
Одно из реагирующих веществ взято в избытке
|
из
5.00
|
Водный раствор, содержащий 19,6 г ортофосфорной кислоты, полностью нейтрализовали раствором, содержащим 44 г гидроксида калия. Рассчитайте массу образовавшейся при нейтрализации воды.
Дано: m(H3PO4) = 19,6 г m(KOH) = 44 г
Найти: m(H2O)= ?
М(Н2О)=18 г/моль
М (H3PO4)=98 г/моль
М(КОН)=56 г/моль
Решение.
1. Составим уравнение полной нейтрализации ортофосфорной кислоты гидроксидом калия
0,2 моль 0,79 моль X
H3PO4 + 3KOH = K3PO4 + 3H2O
1 моль 3 моль 3 моль
2. Рассчитаем количества вещества реагирующих веществ
ν(H3PO4) = 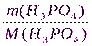 =
=  =
= 
ν(KOH) = 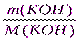 =
=  =
= 
3. Определим, какое из исходных веществ взято в избытке. Для этого сравним количество вещества, взятое по условию задачи, и необходимое по уравнению реакции.
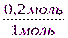 <
< 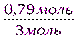
Гидроксид кали взят в избытке, следовательно, расчет проводим по фосфорной кислоте.
4. Вычислим количество вещества воды (по уравнению реакции)
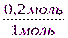 =
=  ; x= 0,6 моль (Н2О)
; x= 0,6 моль (Н2О)
5. Вычисляем массу образовавшейся воды.
m(H2O) = ν· M = 0,6 моль · 18 г/моль = 10,8г
Ответ: m(H2O) = 10,8 г
Исходное вещество содержит примеси.
Железная руда содержит Fe3O4, неметаллические примеси в этой руде составляют 35%. Определите массу железа, восстановленного угарным газом из руды массой 200 кг.
Дано: m(руды) = 200 кг ω(примесей)= 35%
Найти: m(Fe) =?
М(Fe3O4)=232 г/моль
Решение.
1. Составим уравнение восстановления железа угарным газом
0,56 кмоль X
2Fe3O4 + 8CO = 6Fe + 8CO2
2 кмоль 6 кмоль
2. Определим массовую долю и массу оксида железа Fe3O4 в руде
ω(Fe3O4) = 100% - 35% = 65%
m(Fe3O4) = ω · m(руды)=0,65· 200 кг = 130 кг
3. Определим количество вещества оксида железа Fe3O4
ν(Fe3O4) = 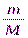 =
=  =
= 
4.По уравнению реакции рассчитаем количество вещества железа и его массу.
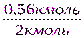 =
= 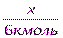 ; x =
; x = 
m(Fe) = ν·M = 1,68 кмоль· 56кг/кмоль = 94,08 кг
Ответ: m(Fe) = 94,08 кг
Расчет массы (объема) продукта реакции с учетом массовой (объемной) доли выхода продукта реакции
Через 600 г раствора азотной кислоты, содержащий 42% HNO3, пропустили избыток аммиака. Получили нитрат аммония массой 300 г. Определите массовую долю выхода продукта реакции к теоретически возможному.
Дано: m(раствора) = 600г ω(HNO3) = 42% mпракт.(NH4NO3) = 300г
Найти: η=?
М(HNO3)=63 г/моль
М(NH4NO3)=80 г/моль
Решение.
1. В задачах на расчет массовой доли
выхода продукта реакции используются два значения массы продукта:
mпракт. (реально полученная) и
mтеорет.(масса, рассчитанная по уравнению реакции).
η= 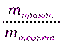 · (100%)
· (100%)
2. Составим уравнение реакции
4 моль X
HNO3 + NH3 = NH4NO3
1 моль 1 моль
3. Определим массу азотной кислоты в растворе и ее количество вещества.
m(HNO3) = ω·mраствора= 0,42·600г=252г
ν(HNO3) =  =
= 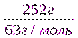 =4 моль
=4 моль
4. Рассчитаем количество вещества и mтеорет. нитрата аммония (по уравнению реакции)
 =
= 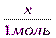 ; x= 4 моль (NH4NO3)
; x= 4 моль (NH4NO3)
mтеорет. (NH4NO3)= ν · M= 4 моль *
*80 г/моль= 360 г
Теоретическое значение массы всегда
больше практического значения.
5. Рассчитаем массовую долю выхода продукта реакции
η= 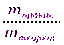 ·
·  =
=  =
= 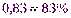
Ответ: η=83%
|
из
5.00
|
Обсуждение в статье: Одно из реагирующих веществ взято в избытке |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

