 |
Главная |
Рабочее тело. Основные параметры состояния
|
из
5.00
|
Предметом технической термодинамики является главным образом изучение процессов взаимного преобразования теплоты и работы в различных тепловых машинах. В тепловых двигателях преобразование теплоты в работу осуществляется при помощи так называемого рабочего тела. Рабочее тело - газообразное, жидкое или плазменное вещество, с помощью которого осуществляется преобразование какой-либо энергии при получении механической работы, холода, теплоты.
Например, в ДВС, а также в газотурбинных установках рассматриваются процессы, в которых рабочим телом является газ. В паровых двигателях рабочим телом является пар, легко переходящий из парообразного состояния в жидкое и, наоборот, из жидкого в парообразное.
Физическое состояние тела вполне определяется некоторыми величинами, характеризующими данное состояние, которые в термодинамике называются параметрами состояния. Параметры состояния взаимно связаны, и любые из них можно рассматривать в качестве основных, а другие - в качестве производных. В технической термодинамике в качестве основных принято три параметра: удельный объем, абсолютная температура и абсолютное давление, которые связаны между собой вполне определенными математическими зависимостями.
У д е л ь н ы й о б ъ е м. Удельный объемv - это объем, занимаемый единицей массы рабочего тела. Если V - полный объем, занимаемый рабочим телом в м 3,m - его масса в кг, то
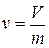 [м3/кг] (1.1)
[м3/кг] (1.1)
Плотность тела определяется как масса единицы объема
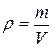 [кг/м3]. (1.2)
[кг/м3]. (1.2)
Удельный объем есть величина, обратная плотности, т.е.
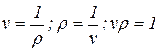 (1.3)
(1.3)
Т е м п е р а т у р а. Температура, характеризуя степень нагретости тела, представляет собой меру средней кинетической энергии поступательного движения его молекул, т.е. температура характеризует среднюю интенсивность движения молекул, и, чем больше эта средняя скорость движения молекул, тем выше температура тела. Понятие температуры не может быть применено к одной или нескольким молекулам. Если два тела с различными средними кинетическими энергиями движения молекул привести в соприкосновение, то тело с большей кинетической энергией молекул /с большей температурой/ будет отдавать энергию телу с меньшей средней кинетической энергией молекул /с меньшей температурой/, и этот процесс будет протекать до тех пор, пока средние кинетические энергии молекул обоих тел не сравняются, т.е. не выровняются температуры обоих тел. Такое состояние двух тел называется тепловым равновесием.
В технике для измерения температур используют различные свойства тел: расширение тел от нагревания в жидкостных термометрах; изменение электрического сопротивления проводника при нагревании в термометрах сопротивления; изменение электродвижущей силы в цепи термопары при нагревании или охлаждении ее спая и др.
Параметром состояния рабочего тела является абсолютная температура, измеряемая в градусах Кельвина /К/. Между температурами, выраженными в градусах Кельвина и Цельсия, имеется следующая связь:
T = t + 273,15(1.4)
Абсолютная температура - величина всегда положительная, т.к. в данном случае отсчет температуры ведется по шкале, характеризуемой тем, что нулевая точка этой шкалы представляет собой наинизшую термодинамически возможную температуру. Эта точка называется абсолютным нулем.
Д а в л е н и е. Давление с точки зрения молекулярно-кинетической теории есть средний результат ударов молекул газа, находящихся в непрерывном хаотическом движении, о стенки сосуда, в котором заключен газ, и представляет собой нормальную составляющую силы, действующей на единицу поверхности.
Различают абсолютное, избыточное, барометрическое /атмосферное/ и вакуумметрическое давления. Термодинамическим параметром состояния является только абсолютное давление. Абсолютное давление - это полное давление, производимое паром или газом.
Пусть к сосуду, в котором находится, например, газ, подсоединен манометр /прибор для измерения давления/. Когда давление газа 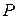 равно давлению внешней среды, т.е. барометрическому давлению
равно давлению внешней среды, т.е. барометрическому давлению 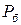
 , то стрелка манометра находится на нуле шкалы. Когда же давление газа превышает барометрическое, стрелка отклоняется, показывая избыток давления газа над барометрическим, т.е. избыточное давление
, то стрелка манометра находится на нуле шкалы. Когда же давление газа превышает барометрическое, стрелка отклоняется, показывая избыток давления газа над барометрическим, т.е. избыточное давление 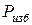 (рис. 1.1). Таким образом,
(рис. 1.1). Таким образом,
Ра = Ризб + Рб.(1.5)
Если абсолютное давление Раменьше барометрического Рб, то величина Н, показывающая на сколько Ра меньше Рб, называется разрежением или вакуумом.
Н=Рвак= Рб - Ра ; Ра = Рб - Н. (1.6)
Избыточное давление измеряется манометром, а разрежение - вакуумметром.
Давление в системе СИ измеряется в паскалях:
1Па = 1Н/м2 = 10-3кПа = 10-6МПа.
В технических расчетах пользуются иногда внесистемной единицей - баром: 1 бар = 105Па.
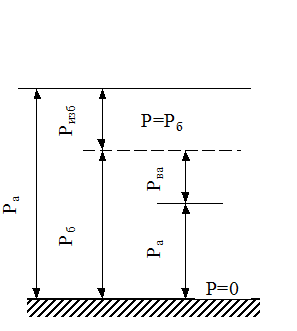
|
1.3 Термодинамическая система и окружающая среда.
1.3.1 Уравнение состояния
При термодинамическом изучении какого-либо явления в качестве объекта исследования выделяется группа тел или единичное тело, или даже отдельные его части.
Термодинамической системой называется совокупность макроскопических материальных тел, являющихся объектом изучения и находящихся во взаимодействии как друг с другом, так и с окружающими их телами. Последние поэтому называют окружающей средой. Указанное взаимодействие заключается в общем случае в обмене теплотой и работой между термодинамической системой и окружающей средой. Этот обмен происходит через поверхности, ограничивающие систему и отделяющие ее от среды.
Если термодинамическая система не имеет никаких взаимодействий с окружающей средой, то ее называют изолированной или замкнутой системой.
Система, окруженная так называемой адиабатной оболочкой, исключающей теплообмен с окружающей средой, называется теплоизолированнойили адиабатной системой.
Система, имеющая во всех своих частях одинаковый состав и физические свойства, называется однородной. Однородная термодинамическая система /как по составу, так и по физическому строению/, внутри которой нет поверхности раздела, называется гомогенной /например, лед, вода, газы/.
Система, состоящая из нескольких макроскопических частей с различными физическими свойствами, отделенных одна от другой видимыми поверхностями раздела, называется гетерогенной /например, лед и вода, вода и пар и др./
Гомогенные части системы, отделенные от остальных частей видимыми поверхностями раздела, называются фазами. В зависимости от числа фаз гетерогенные системы называются двухфазными и трехфазными /газообразное, жидкое, твердое состояния/.
Компонентом термодинамической системы называют всякое химически однородное вещество.
Термодинамическая система, занимающая определенный объем, находится в равновесном состоянии /равновесии/ в том случае, если параметры системы во всех частях этого объема, как бы малы они ни были, имеют одинаковые значения. Для такой равновесной системы может быть установлена определенная аналитическая зависимость между параметрами ее состояния. В самом общем случае эта зависимость имеет вид:
F(P, v, T) = 0,(1.7)
которое в термодинамике называют термическим уравнением состояния, а параметры P, v, T называются основными термическими параметрами термодинамической системы.

Термическому уравнению состояния можно придать следующий вид:
P = ¦1(v, T);
v = ¦2(P, T);(1.8)
T = ¦3(v, p),
свидетельствующий о том, что любой из параметров состояния системы является функцией остальных ее параметров. В термодинамике такие функции называются функциями состояния.
С математической точки зрения уравнение состояния (1.7) в пространственной ортогональной системе координат v-P-T является уравнением некоторой поверхности, называемой термодинамической. Все состояния термодинамической системы, подчиняющиеся уравнению (1.7), характеризуются точками, лежащими на термодинамической поверхности. Координаты отдельных точек, например, А, РА, vА, ТА определяют параметры системы в данном состоянии. Каждому равновесному состоянию термодинамической системы соответствует определенная точка на термодинамической поверхности.
1.4 Термодинамический процесс. vP-диаграмма и термодинамические процессы в ней /равновесные и неравновесные, обратимые и необратимые, круговой процесс/.
Термодинамическим процессомназывается совокупность последовательных состояний, через которые проходит термодинамическая система при взаимодействии ее с внешней средой. При этом все или часть параметров претерпевают изменения. Если изменения параметров проходят таким образом, что в любом промежуточном состоянии система находится в равновесии, то такие процессы называются равновесными.
Термодинамика в первую очередь рассматривает равновесные состояния и равновесные процессы изменения состояния термодинамической системы. Только равновесные состояния могут быть описаны количественно с помощью уравнения состояния.
Равновесный процесс можно осуществлять при бесконечно медленном изменении внешних условий или когда изменения параметров, характеризующих состояние системы, бесконечно малы по сравнению со значениями самих параметров. Следовательно, реальные процессы, будучи неравновесными, могут лишь в той или иной степени приближаться к равновесным, никогда в точности с ними не совпадая. Неравновесность реальных процессов определяется прежде всего конечными скоростями, и в рабочем теле не успевает устанавливаться равновесное состояние. Например, при быстром расширении газа в цилиндре под поршнем или его сжатии, температура и давление в различных точках объема рабочего тела не будут одинаковыми, т.е. процесс будет неравновесным.
Графически равновесный процесс изображается кривой, всеми своими точками лежащей на равновесной поверхности /кривая ВСна рис. 1.2/.
Графическое изучение термодинамических процессов было бы затруднено при использовании пространственной системы координат, поэтому для изображения процессов пользуются не самими кривыми, а их проекциями в прямоугольной системе координат.
Если термодинамическую поверхность рассечь плоскостями, параллельными осям координат, то на поверхности получатся следующие кривые: при v = const - процесс изменения давления в зависимости от температуры в координатах РТ /изохорный процесс/; при Р = const - процесс изменения удельного объема в зависимости от температуры в координатах vT /изобарный процесс/; при Т = const - процесс изменения давления в зависимости от удельного объема в координатах vР /изотермический процесс/.
Чаще всего для исследования термодинамических процессов в технической термодинамике применяют двухосную систему координат vP.
Равновесный процесс, протекающий при отсутствии трения, называется обратимым. Под трением в широком смысле слова здесь понимается любой процесс непосредственного превращения различных видов энергии в тепловую. Обратимый процесс может протекать самопроизвольно как в прямом, так и в обратном направлениях, проходя через те же самые равновесные состояния. В результате прямого и обратного процессов термодинамическая система и окружающая среда возвращаются в исходное состояние без остаточных изменений.
Необратимымназывается процесс, который либо вообще невозможен в обратном направлении по тому же самому пути, либо требует для своего осуществления дополнительных внешних затрат. Если нарушается хотя бы одно из условий обратимости, то процесс будет необратимым.
Необратимыми являются все реальные процессы, поскольку они протекают с трением в условиях динамического и термического неравновесия. Например, процесс теплообмена между двумя телами при конечной разности температур /Т1¹ Т2/ самопроизвольно идет лишь в одном направлении: теплота передается от тела более нагретого к телу менее нагретому до достижения температурного равновесия между ними. Для осуществления обратного процесса требовалось бы за счет затрат извне нагреть прежде менее нагретое тело до первоначальной температуры более нагретого тела.
Обратимый процесс является идеальным, но он более прост и удобен для термодинамического анализа, поэтому техническая термодинамика занимается изучением прежде всего обратимых процессов. Влияние необратимости учитывается с помощью опытных поправок и коэффициентов. Это позволяет оценивать степень необратимости того или иного процесса по отношению к процессу в зависимости от величины дополнительных внешних затрат /например, работы/ для возвращения системы в исходное состояние.
При изучении термодинамических процессов особое значение имеют так называемые замкнутые, или круговые процессы, при которых система, проходя через ряд последовательных состояний, возвращается к начальному состоянию. Круговой процесс называют также циклом.
Изменение параметра состояния в любом термодинамическом процессе не зависит от вида процесса, а целиком определяется начальным и конечным состоянием. Поэтому любой параметр состояния является функцией состояния.
Следует отметить, что параметры состояния могут зависеть или не зависеть от массы термодинамической системы. Параметры состояния, не зависящие от массы системы, называются интенсивными параметрами /давление, температура и др./. Параметры, величины которых пропорциональны массе системы, называются аддитивными, или экстенсивными параметрами /объем, энергия и др./.
|
из
5.00
|
Обсуждение в статье: Рабочее тело. Основные параметры состояния |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

