 |
Главная |
Вычисление параметров состояния смеси
|
из
5.00
|
Таблица 2.1 - Формулы для расчета газовых смесей
| Массовыми долями | Объемными долями | |
| Перевод из одного состава в другой | 
| 
|
| Плотность и удельный объем смеси | 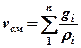 ; ; 
|  ; ; 
|
Продолжение таблицы 2.1.
| Массовыми долями | Объемными долями | |
| Кажущаяся молекулярная масса смеси | 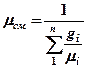
| 
|
| Газовая постоянная смеси | 
| 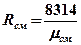
|
| Парциальные давления компонентов | 
| 
|
Реальные газы
В реальных газах в отличие от идеальных существенны силы межмолекулярных взаимодействий (силы притяжения, когда молекулы находятся на значительном расстоянии друг от друга и силы отталкивания при достаточном сближении их друг с другом) и нельзя пренебречь собственным объемом молекул.
Для характеристики отличия термических свойств реального газа от свойств идеального газа обычно применяют коэффициент сжимаемости
 .
.
Если коэффициент сжимаемости z для идеального газа равен 1, то для реальных газов в зависимости от давления и температуры z может быть больше или меньше 1. На рис. 2.2. приведена зависимость коэффициента сжимаемости некоторых реальных газов от давления при температуре 0°С. Зависимость z(P) при T=const для идеального газа – горизонтальная прямая. Для реального газа с увеличением давления z сначала уменьшается, а затем увеличивается. Это связано с наличием сил взаимного притяжения между молекулами, которые делают газ более сжимаемым, а наличие объема самих молекул, которые уменьшают свободный объем, делает реальный газ менее сжимаемым.

Рис. 2.2. Зависимость z(P) для некоторых газов при температуре 0 °С
Теория идеальных газов не учитывает свойство газов при определенных условиях изменять свое агрегатное состояние (превращение газа в жидкость).
В уравнение введены поправки, учитывающие силы взаимодействия между молекулами и влияние объема самих молекул. Простейшее уравнение состояния реальных газов – уравнение Ван-дер-Ваальса:
 , (2.26)
, (2.26)
где  - характеристика внутреннего давления, обусловленного силами притяжения молекул;
- характеристика внутреннего давления, обусловленного силами притяжения молекул;
 свободный объем, т.е. объем пространства, в котором могут перемещаться молекулы, где
свободный объем, т.е. объем пространства, в котором могут перемещаться молекулы, где  - тот наименьший объем, до которого можно сжать газ.
- тот наименьший объем, до которого можно сжать газ.
Уравнение Ван-дер-Ваальса отражает непрерывность газообразного и жидкого состояний и отражает параметры обеих фаз. Изотермы, построенные по уравнению Ван-дер-Ваальса для разных температур изображены на рис. 2.3.
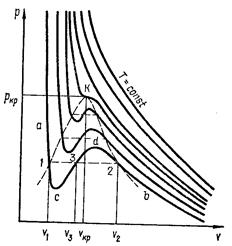
Рис. 2.3. Изотермы Ван - дер - Ваальса
Уравнение Ван-дер-Ваальса – уравнение 3-й степени относительно объема и имеет три корня ( 3 действительных при Т< Ткр, т.е. v1>v2>v3; 1 действительный и 2 мнимых при Т>Ткр, т.е. каждому давлению соответствует определенный объем; все 3 корня действительны и равны между собой при Т= Ткр, т.е. v1 = v2 = v3). Участок изотермы справа от т.2 (область больших объемов) близок к изотерме идеального газа.
При большом объеме газа обе поправки невелики:  и
и 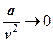 , и левая часть близка к
, и левая часть близка к  . По мере уменьшения v поправки начинают играть заметную роль. В точке 2 газ начинает превращаться в жидкость (конденсироваться). Волнообразный участок изотермы 2-d-c-1 - отражает неустойчивое состояние. Состояния с и d могут быть получены при очень медленном и спокойном сжатии газа и при отсутствии центров конденсации в виде пылинок, капелек тумана или других частиц. Такой ход изотермы между точками 2и 1практически не достигается.
. По мере уменьшения v поправки начинают играть заметную роль. В точке 2 газ начинает превращаться в жидкость (конденсироваться). Волнообразный участок изотермы 2-d-c-1 - отражает неустойчивое состояние. Состояния с и d могут быть получены при очень медленном и спокойном сжатии газа и при отсутствии центров конденсации в виде пылинок, капелек тумана или других частиц. Такой ход изотермы между точками 2и 1практически не достигается.
На рис 2.4 приведены действительные изотермы реального газа. Давление между точками 2и 1остается неизменным, т.к. уменьшение объема происходит за счет частичной конденсации газообразной фазы. В т.1 весь газ (пар) превращается в жидкость, и дальнейшее повышение давления будет незначительно изменять объем жидкости.

Рис. 2.4. Изотермы реального газа
С повышением температуры длина горизонтального участка уменьшается, и в некоторой точке точки 1и 2 сливаются в одну. Эта точка (К на рис 2.4), называемая критической, характеризует критическое состояние вещества. Параметры вещества в этом состоянии называются критическими и обозначаются  и
и  . Критическая точка является верхней границей двухфазной области, где возможно равновесное состояние жидкости и пара. При Т>
. Критическая точка является верхней границей двухфазной области, где возможно равновесное состояние жидкости и пара. При Т>  изотермы реального газа приближаются к изотермам идеального газа, участок с двухфазным состоянием отсутствует.
изотермы реального газа приближаются к изотермам идеального газа, участок с двухфазным состоянием отсутствует.
3 ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ
|
из
5.00
|
Обсуждение в статье: Вычисление параметров состояния смеси |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

