 |
Главная |
Уравнение состояния идеальных газов. Газовая постоянная
|
из
5.00
|
Как было отмечено ранее, в термодинамических системах в качестве рабочего тела часто рассматривается идеальный газ, являющийся теоретической моделью газа, в которой не учитываются взаимодействия частиц газа - молекул, представляющих собой материальные точки, не имеющие объема и сил межмолекулярного сцепления.
Основные параметры состояния (абсолютное давление, удельный объем и абсолютная температура) однородного тела зависят один от другого и взаимно связаны уравнением состояния F(P, v, T) = 0. Из молекулярно-кинетической теории следует, что абсолютное давление газа численно равно  средней кинетической энергии поступательного движения молекул, заключенных в единице объема:
средней кинетической энергии поступательного движения молекул, заключенных в единице объема:
 (2.4)
(2.4)
где n - число молекул в удельном объеме; v - удельный объем газа; m - масса молекулы; v - средняя квадратичная скорость поступательного движения молекул; 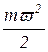 - средняя кинетическая энергия молекулы.
- средняя кинетическая энергия молекулы.
Молекулярно-кинетическая теория газов устанавливает прямо пропорциональную зависимость между средней кинетической энергией молекулы и абсолютной температурой:
 (2.5)
(2.5)
где Т - абсолютная температура; В - коэффициент пропорциональности.
С учетом (2.2) уравнение (2.1) можно представить в виде
 (2.6)
(2.6)
Если уравнение (2.3) отнести к двум состояниям газа, то для каждого из них получаем:


Почленное деление этих уравнений приводит к следующему соотношению:
 (2.7)
(2.7)
Это соотношение между параметрами состояния может быть получено из совместного рассмотрения законов Бойля-Мариотта и Гей-Люссака, поэтому часто это соотношение называют объединенным законом Бойля-Мариотта и Гей-Люссака.
Выражение (2.8) показывает, что произведение абсолютного давления идеального газа и удельного объема, деленное на абсолютную температуру, для любого равновесного состояния есть величина постоянная:
 . (2.8)
. (2.8)
Постоянную величину обозначают R и называют удельной газовой постоянной:
 или
или  (2.9)
(2.9)
Уравнение (2.9) называют термическим уравнением состояния идеальных газов или характеристическим уравнением, однозначно связывающим между собой параметры P, v, T. Это уравнение было выведено французским физиком Клапейроном в 1834 году и поэтому названо его именем.
Для произвольного количества газа массой m [кг] уравнение состояния имеет вид:
Pv = mRT, (2.10)
где P- абсолютное давление газа в Па; v - объем рассматриваемого количества газа в м3;
m - масса газа в кг; T - абсолютная температура газа в К.
Выясним физический смысл удельной газовой постоянной. Запишем уравнение Клапейрона для двух состояний газа при одном и том же давлении:


Вычитая из второго уравнения первое, получим:
P(V2-V1) = mR(T2-T1),(2.11)
откуда
 . (2.12)
. (2.12)
Числитель правой части представляет собой работу газа в процессе при постоянном давлении. Если разность температур равна 1К, а масса газа равна 1кг, то удельная газовая постоянная есть работа в Дж 1кг газа в процессе при постоянном давлении и при изменении температуры на 1К.
Удельная газовая постоянная имеет следующую размерность:
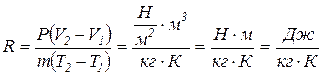
Удельная газовая постоянная представляет собой физическую постоянную, которая для каждого газа имеет вполне определенное значение, зависящее от природы газа и не зависящее от его состояния.
Уравнение Клапейрона в рассмотренном виде может применяться не только для идеальных газов, но и для реальных газов, имеющих низкое давление и высокую температуру.
Если m - молярная масса газа, то умножив на m обе части уравнения (2.9), получим уравнение Клапейрона-Менделеева:
Pvm = RmT; Pvm = RmT, (2.13)
где vm = vm - молярный объем рабочего тела [м3/моль] при нормальных физических условиях (давлении 101325 Па и температуре 273,15К), объем 1 кмоль газа равен 22,4143 м3/кмоль;
Rm = mR - универсальная газовая постоянная, равная
 Дж/(кмоль×К)
Дж/(кмоль×К)
Уравнение (2.13) впервые было предложено Менделеевым в 1874 году и является наиболее общим для идеальных газов.
Газовая постоянная одного килограмма газа:
 . (2.14)
. (2.14)
Смеси идеальных газов
|
из
5.00
|
Обсуждение в статье: Уравнение состояния идеальных газов. Газовая постоянная |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

