 |
Главная |
Вычисление энтропии идеального газа
|
из
5.00
|
Формулы для вычисления изменения энтропии идеального газа могут быть получены из уравнения первого закона термодинамики:
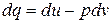
В процессе при v=const , в котором тело не совершает внешней работы
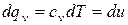
Или, заменив Р на 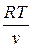 из уравнения Клапейрона, получим
из уравнения Клапейрона, получим
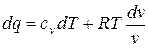
Разделив обе части последнего уравнения на Т, имеем:
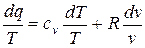
Так как 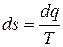 , то
, то
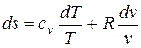 (5.1)
(5.1)
Интегрируя (5.1) при cv=const, найдем
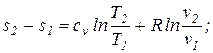
Таким образом, получено уравнение для вычисления энтропии как функции температуры и удельного объема 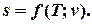
Для получения изменения энтропии как функции температуры и давления 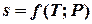 следует из уравнения (5.1) исключить
следует из уравнения (5.1) исключить 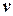 .
.
Из уравнения Клапейрона после дифференцирования получаем
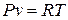 ;
;
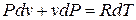 ;
;
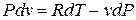 .
.
Так как 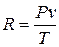 ,то
,то
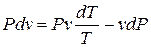
Или, разделив на 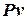 :
:
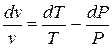 .
.
Подставляя из последнего выражения 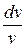 в уравнение (5.1) и учитывая, что из уравнения Майера
в уравнение (5.1) и учитывая, что из уравнения Майера 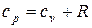 , найдем:
, найдем:
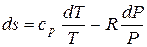 . (5.2)
. (5.2)
Интегрируя последнее уравнение при 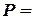 const, получаем выражение для определения изменения энтропии как функции температуры и давления
const, получаем выражение для определения изменения энтропии как функции температуры и давления
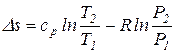 .
.
Для получения изменения энтропии как функции давления и удельного объема следует из уравнения (5.2) исключить 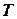 .
.
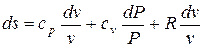 ;
;
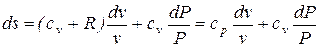 ;
;
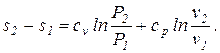 (5.3)
(5.3)
Изохорный процесс
Термодинамический процесс, протекающий при 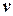 =const или
=const или 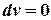 , называется изохорным, а кривая процесса – изохорой.
, называется изохорным, а кривая процесса – изохорой.
Таблица 5.2 – Исследование изохорного процесса
| Метод исследования | Формулы |
1. Уравнение кривой процесса в  - диаграмме - диаграмме
|  , , 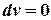
|
2. График процесса в 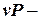 и и  - координатах - координатах
| |
Изохора 1-2 – вертикальная прямая, параллельная оси  В процессе 1-2 теплота подводится к газу, давление повышается.
В обратном процессе 2-1 теплота от газа отводится, давление понижается.
В процессе 1-2 теплота подводится к газу, давление повышается.
В обратном процессе 2-1 теплота от газа отводится, давление понижается.
| 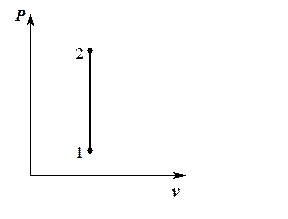
|
Pис. 5.1.
Изохорный процесс в 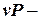 координатах координатах
| |
Площадь под изохорным процессом в 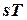 -диаграмме (пл. 1234) численно равна количеству теплоты, которая расходуется на изменение внутренней энергии рабочего тела, а подкасательная к кривой в любой точке дает значение истинной теплоемкости cv.
Чем больше объем газа, тем дальше находится изохора от оси координат. -диаграмме (пл. 1234) численно равна количеству теплоты, которая расходуется на изменение внутренней энергии рабочего тела, а подкасательная к кривой в любой точке дает значение истинной теплоемкости cv.
Чем больше объем газа, тем дальше находится изохора от оси координат.
| 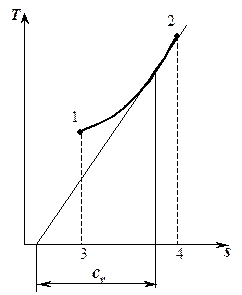
|
Pис. 5.2.
Изохорный процесс в  - координатах - координатах
|
Продолжение таблицы 5.2
| Метод исследования | Формулы |
| 3. Изохорный процесс описывается уравнением состояния в виде: При изохорном процессе давление газа пропорционально абсолютной температуре (закон Шарля): |
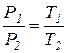
|
| 4. Изменение внутренней энергии газа при постоянной теплоемкости | 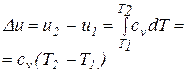
|
5. Внешняя работа газа при 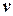 =const равна нулю, так как =const равна нулю, так как 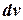 =0. =0.
| 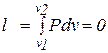 
|
| 6. Удельная располагаемая работа в изохорном процессе: | 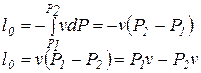
|
| 7. Вся подведенная теплота в рассматриваемом процессе идет на изменение внутренней энергии рабочего тела. | 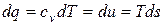
|
| Изменение энтальпии в изохорном процессе: | 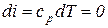 , ,
|
| 9. Изменение удельной энтропии в обратимом изохорном процессе определяется по формуле: | 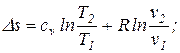
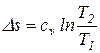 . .
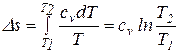 . .
|
10. Так как в изохорном процессе 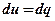 , то доля теплоты, расходуемая на изменение внутренней энергии, равна: , то доля теплоты, расходуемая на изменение внутренней энергии, равна:
| 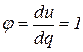
|
| 11. Доля теплоты, расходуемая на совершение работы | 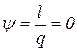
|
На рис. 5.3. показано распределение теплоты в изохорном процессе
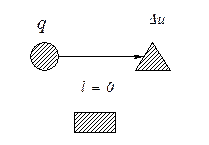 a
a
| 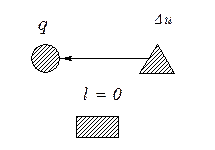 б
б
|
Рис. 5.3. Схема распределения теплоты в изохорном процессе:
|
из
5.00
|
Обсуждение в статье: Вычисление энтропии идеального газа |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

