 |
Главная |
Линейчатые спектры. Боровская теория атома водорода
|
из
5.00
|
Экспериментальные исследования спектров излучения отдельных атомов (разреженные газы) показали, что каждому газу присущ свой линейчатый спектр, состоящий из отдельных спектральных линий или групп близко расположенных линий (серий линий). Положение линий в спектре может быть описано простыми эмпирическим формулами. Так, положение серий линий атома водорода описывается обобщённой формулой Бальмера:
 , (86)
, (86)
где ν - частота спектральных линий в спектре, R-постоянная Ридберга (  ), m = 1,2,3,4.. определяет серию, n= m+1, m+2, m+3… определяет отдельные линии этой серии.
), m = 1,2,3,4.. определяет серию, n= m+1, m+2, m+3… определяет отдельные линии этой серии.
Аналогичные серии были выделены в линейчатых спектрах других атомов.
Для объяснения закономерностей в линейчатых спектрах Бор объединил планетарную модель атома с гипотезой Планка о квантовом характере излучения.
Постулаты Бора.
Первый постулат Бора (постулат стационарных состояний):
существуют стационарные (не изменяющиеся со временем) состояния атома, находясь в которых он не излучает энергии. Стационарным состояниям атома соответствуют стационарные орбиты, по которым движутся электроны. Каждое стационарное состояние характеризуется определенным (дискретным) значением энергии. Движение электронов по стационарным орбитам не сопровождается излучением электромагнитных волн.
 Бор предположил, что момент импульса электрона в атоме также должен принимать только определенные дискретные значения:
Бор предположил, что момент импульса электрона в атоме также должен принимать только определенные дискретные значения:
L=mvr=nћ, n=1, 2, … , (87)
Второй постулат Бора (правило частот): при переходе атома из одного состояния в другое испускается или поглощается один фотон с энергией
hν=En-Em (88)
равной разности энергий соответствующих стационарных состояний.
Излучение происходит при переходе атома из состояния с бoльшей энергией в состояние с меньшей энергией (при переходе электрона с орбиты более удаленной от ядра на ближнюю к ядру орбиту). Если же электрон поглощает энергию, он может перейти на более высокий уровень энергии. Можно рассчитать радиусы стационарных орбит электрона, значения энергии и спектральные серии, наблюдаемые в излучении ( Рис.27 )
Рис.27.
 – первый боровский радиус (89)
– первый боровский радиус (89)
 – постоянная тонкой структуры. (90)
– постоянная тонкой структуры. (90)
Энергия электрона в атоме водорода:
 , (91)
, (91)
где  –энергия ионизации атома
–энергия ионизации атома
 – постоянная Ридберга (92)
– постоянная Ридберга (92)
Энергия, излучаемая или поглощаемая атомом водорода:
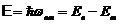 ,
,
где n и m – квантовые числа, соответствующие энергетическим уровням, между которыми совершается переход электрона в атоме.
Формула Бальмера для водородоподобных атомов:
 , (93)
, (93)
или
 , (94)
, (94)
или
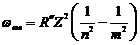 , (95)
, (95)
где  – квантовое число, характеризующие уровни серии, лежащие выше уровня с квантовым числом n;
– квантовое число, характеризующие уровни серии, лежащие выше уровня с квантовым числом n;
Z – заряд ядра.
В опытах Франка и Герца было экспериментально доказано
существование в атомах стационарных состояний.
|
из
5.00
|
Обсуждение в статье: Линейчатые спектры. Боровская теория атома водорода |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

