 |
Главная |
Законы электролиза. Применение электролиза.
|
из
5.00
|
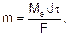 Процессы электролиза подчиняются законам Фарадея: Первый закон: Масса электролита, подвергшаяся химическому превращению, а также массы веществ, выделившихся на электродах, прямо пропорциональны количеству электричества, прошедшему через расплав или раствор электролита. Второй закон: При пропускании одинакового количества электричества через растворы или расплавы различных электролитов масса веществ, выделяющихся на электродах, пропорциональна их химическим эквивалентам. Для расчетов используют объединенное уравнение законов Фарадея:
Процессы электролиза подчиняются законам Фарадея: Первый закон: Масса электролита, подвергшаяся химическому превращению, а также массы веществ, выделившихся на электродах, прямо пропорциональны количеству электричества, прошедшему через расплав или раствор электролита. Второй закон: При пропускании одинакового количества электричества через растворы или расплавы различных электролитов масса веществ, выделяющихся на электродах, пропорциональна их химическим эквивалентам. Для расчетов используют объединенное уравнение законов Фарадея:
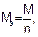 где m – масса электролита, подвергшаяся химическому превращению, или масса вещества, выделившегося на электроде, г; Мэ – молярная масса эквивалентов вещества, г/моль; J – сила тока, А; t - время электролиза, с; F – число Фарадея (96500 Кл/моль). Молярная масса эквивалентов вещества рассчитывается по формуле:
где m – масса электролита, подвергшаяся химическому превращению, или масса вещества, выделившегося на электроде, г; Мэ – молярная масса эквивалентов вещества, г/моль; J – сила тока, А; t - время электролиза, с; F – число Фарадея (96500 Кл/моль). Молярная масса эквивалентов вещества рассчитывается по формуле:
где М – молярная масса вещества, г/моль; n – число электронов, участвующих в электродном процессе.
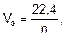 Для расчета объемов газообразных продуктов электролиза в законе Фарадея молярная масса эквивалентов вещества Мэ заменяется на молярный объем эквивалента газа при нормальных условиях (Vэ), который рассчитывается по формуле:
Для расчета объемов газообразных продуктов электролиза в законе Фарадея молярная масса эквивалентов вещества Мэ заменяется на молярный объем эквивалента газа при нормальных условиях (Vэ), который рассчитывается по формуле:
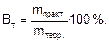 где 22,4 – это объем, который занимает 1 моль любого газа при нормальных условиях, л; n – число
где 22,4 – это объем, который занимает 1 моль любого газа при нормальных условиях, л; n – число 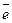 , отданных или принятых 1 моль газа. При проведении электролиза в реальных условиях, вследствие побочных процессов масса вещества, выделившегося на электроде, оказывается меньше массы, рассчитанной по закону Фарадея. Отношение массы вещества, полученной при электролизе (mпракт.) к массе вещества, рассчитанной по закону Фарадея (mтеор.), выраженное в процентах, называется выходом по току (Вт):
, отданных или принятых 1 моль газа. При проведении электролиза в реальных условиях, вследствие побочных процессов масса вещества, выделившегося на электроде, оказывается меньше массы, рассчитанной по закону Фарадея. Отношение массы вещества, полученной при электролизе (mпракт.) к массе вещества, рассчитанной по закону Фарадея (mтеор.), выраженное в процентах, называется выходом по току (Вт):
ЗАКОНЫ ЭЛЕКТРОЛИЗА Количественная сторона электролиза выражается законом Фарадея: Количество выделившегося на электроде вещества прямо пропорционально силе тока и времени электролиза и определяется следующей формулой: 𝑚=Э𝐼∙𝑡 𝐹=𝑀∙𝐼∙𝑡 𝑛∙𝐹, где m – масса вещества, образовавшегося на электроде при электролизе, г; Э - эквивалентная масса (г/экв.) вещества, которая равна отношению атомной массы элемента (М) к заряду катиона металла (n); I – сила тока, А; t – время электролиза (с или час); F- постоянная Фарадея, характеризующая количество электричества, необходимое для выделения эквивалентной массы вещества (96500 Кл или 26,8 А·ч). Для процесса электролиза, протекающего с выделением газа, удобнее пользоваться следующей формулой: 𝑉 г=𝑉 э𝐼∙𝑡 𝐹, где Vг – объем газа, выделившегося на электроде, л; Vэ – эквивалентный объем газа при н.у, который равен отношению объема 1 моля газа при н.у. (V) к сумме валентностей элементов молекулы газа (n). Так как 1 моль газа при н.у. занимает объем, равный 22,4 л, следовательно, Vэ для H2 и Cl2 равен 11,2 л, а для О2 – 5,6 л. Совокупность электрохимических методов анализа, основанных на измерении количества электричества, расходуемого при выделении веществ на электродах, называется кулонометрией. В большинстве случаев электрохимическому изменению подвергается меньшая масса данного вещества по сравнению с массой, теоретически ожидаемой в результате расчетов по закону Фарадея. Это связано с тем, что превращению подвергается не одно вещество, а несколько. Поэтому для учета влияния побочных реакций вводится понятие «выход по току». Выход по току ( η , %) – это часть протекшего количества электричества, приходящаяся на долю данной химической реакции: 𝜂𝑖=𝑞𝑖 ∑𝑞𝑖 ∙100 где qi – количество электричества, расходуемое на данную реакцию; Σ qi – общее количество прошедшего электричества.
Применение электролиза. Процессы электролиза получили широкое и разностороннее применение в промышленности: 1. Электролизом расплавов хлоридов щелочных и щелочноземельных металлов получают Na, К, Са, Мg и др. Металлический алюминий получают электролизом расплава оксида алюминия в расплавленном криолите 3NаF∙А1F3. Путем электролиза водного раствора поваренной соли получают едкий натр (каустическую соду) и хлор. Получение водорода, в больших количествах применяемого для синтеза NH3, НС1 и др., осуществляется электролизом H2O (используют не чистую воду, а растворы электролитов, ионы которых разряжаются труднее, чем Н+ и ОН-); 2. Электролитическое окисление в случае, если на аноде выделяются О2 и Сl2, используют для окисления и хлорирования находящихся в растворе веществ. Электролитическое восстановление в случае, когда на катоде выделяется атомарный водород, часто применяется для гидрирования находящихся в растворе неорганических и органических веществ;
3. Гидроэлектрометаллургия – важная отрасль металлургии цветных металлов (Cu, Bi, Sb, Pb, Ni, Co, Cd, Zn); она применяется также для получения благородных и рассеянных металлов. Электролиз используют непосредственно для катодного выделения металла после того, как он переведен из руды в раствор, а раствор подвергнут очистке. Такой процесс называется электроэкстракцией; 4. Электролиз применяется для очистки и получения особо чистых материалов (рафинирование металлов). Этот процесс состоит в анодном растворении загрязненного металла и в последующем его катодном осаждении. Чаще всего этот процесс используется для получения электролитически чистой меди. Листы неочищенной (черновой) меди служат анодом. Процесс сводится к растворению анода и выделению чистой меди на катоде; электролит регенерируется и сохраняется в растворе. 5. Электролитическое покрытие менее благородного металла более благородным металлом (гальваностегия) широко используется для никелирования, хромирования, серебрения, меднения. Хромирование применяется для повышения коррозионной стойкости черных металлов, а также для увеличения твердости поверхностного слоя и сопротивления стиранию. Никелирование используется для изменения внешнего вида изделия. Цинкование и лужение - для защиты от коррозии. Меднение - для нанесения припоя и т.д. Гальваностегия осуществляется аналогично рафинированию меди. Покрываемое изделие служит катодом, покрывающий металл - анодом. 6. Гальванопластика - получение точных копий изделий с использованием электролиза. С ее помощью получают очень тонкослойные изделия для радиотехники и приборостроения. Например, на алюминиевую деталь сложной геометрической формы электролизом наносят слой меди нужной толщины. Затем алюминий растворяют в соляной кислоте или растворе щёлочи, с которыми медь не реагирует. Получают изделие с толщиной стенок, исчисляемой микронами.
Электролиз нашел применение также для травления, оксидирования, полирования, заточки металлов и т.д.
|
из
5.00
|
Обсуждение в статье: Законы электролиза. Применение электролиза. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

