 |
Главная |
Важнейшие окислители и восстановители. Процессы окисления и восстановления. Составление уравнений окислительно-восстановительных реакций. Примеры?
|
из
5.00
|
Восстановители и окислители могут быть как простыми веществами, то есть такими, которые состоят из одного элемента, так и сложными. Согласно их места в периодической системе элементов атомы большинства металлов содержат на внешнем энергетическом уровне 1-2 электрона. Поэтому в химических реакциях они отдают валентные электроны, то есть окисляющиеся. Металлы проявляют восстановительные свойства. В периодах с увеличением порядкового номера элемента восстановительные свойства простых веществ понижаются, а окислительные - возрастают и становятся максимальными у галогенов. Например, в III периоде натрий - самый активный в периоде восстановитель, а хлор - самый активный в периоде окислитель.
У элементов главных подгрупп с повышением порядкового номера усиливаются восстановительные свойства и ослабляются окислительные. Лучшие восстановители-щелочные металлы, а самые активные из них - Fr и Cs. Лучшие окислители - галогены. Элементы главных подгрупп IV - VII групп (неметаллы) могут как отдавать, так и присоединять электроны и проявлять восстановительные и окислительные свойства.
Важнейшие восстановители и окислители
| Восстановитель | Окислитель |
| Металлы, водород, уголь Оксид углерода(II) СО Сероводород H2S, оксид сульфуpy(IV) SO2, сульфитная кислота H2SO3 и ее соли | Галогены Перманганат калия КМnВ4, манганат калия К2МnО4, оксид марганца(ИV) MnO2? |
| Йодоводнева кислота Нl, бромо водородная кислота НВr, хлоровод нева кислота НСl | Дихромат калия К2Сr2О7, хромат калия К2СrO4 Азотная кислота HNO3 |
| Хлорид олова(II) SnCl2, сульфат железа(II) FeSO4, сульфат марганца(II) MgSO4, сульфат хрома(III) Cr2(SO4)3 | Кислород O2, озон О3, пероксид водорода Н2О2 Сульфатная кислота H2SO4 (конц.), селенатна кислота H2SeO4 |
| Нітритна кислота HNO2, аммиак NH3, гидразин N2H4, оксид азота(II) NO Фосфітна кислота Н3РО3 | Оксид купруму(II) СuО, оксид аргентуму(И) Аg2О, оксид свинца(ИV) PbO2 Ионы благородных металлов (Аg, Аu3+ и т.д.) |
| Альдегиды, спирты, муравьиная и оксалатна кислоты, глюкоза | Хлорид железа(III) FeCl3 Гипохлориты, хлораты и перхлорати |
| Катод под время электролиза | Царская водка, смесь концентрированных азотной и плавиковой кислот Анод во время электролиза |
Исключением является фтора. Он выявляет только окислительные свойства, так как имеет наибольшую относительную электроотрицательности (см. табл. 2.2). Элементы побочных подгрупп (парных рядов больших периодов) имеют металлический характер, поскольку на внешнем энергетическом уровне их атомов содержатся 1-2 электроны. Поэтому их простые вещества являются восстановителями. Следовательно, в отличие от простых веществ - металлов, которые выступают в роли восстановителей, простые вещества - неметаллы проявляют себя и как окислители, и как восстановители. Окислительные или восстановительные свойства сложных веществ зависят от степени окисления атома данного элемента. +7 +4 +2. Например, КМnВ4, МnО2, MnSO4. В первой соединении марганец имеет максимальную степень окисления и не может его больше повышать. Он может только присоединять электроны, а значит, КМnO4 может быть только окисником. В третьем соединении в мангану самый низкий степень окисления - она может быть только восстановителем. Во второй соединении марганец имеет промежуточную степень окисления (+4), а поэтому она может быть и восстановителем, и окисником; все зависит от условий течения реакции и веществ, с которыми будет взаимодействовать МnО2. Сложные анионы, содержащие атомы с высокой степенью окисления, также являются окислителями. +5 +7 +6 +5 +7. Например, NO-3, МnО-4, Сr2О2-7, СlO-4, СlВ-4 т.д. Окислительные свойства обуславливает атом с высокой степенью окисления, а целый анион, например не Мn+7, а весь анион М nO 4 -. Элементарные анионы проявляют только восстановительные свойства. Например, F - , С l - , r - , l - , S 2- и др. Окислением называется процесс отдачи электронов атомом или ионом, сопровождающееся повышением степени окисления (к более положительным значениям). Например: Na0 –1 e à Na+ 2Cl- - 2e à Cl20
Восстановлением называется процесс присоединения электронов атомом или ионом, сопровождающийся понижением степени окисления (к более отрицательным значениям). Например: N+5+ 3e à N+2 Fe+3 +1e à Fe+2
Для составления уравнений окислительно-восстанови-тельных реакций и определения коэффициентов применяют два метода: метод электронного баланса и ионно-электронный метод (метод полуреакций). Метод электронного баланса является более простым и учитывает изменение степени окисления элементов в реакциях. Ионно-электронный метод учитывает характер химической связи в молекуле и наличие тех ионов, которые в действительности существуют в растворе, например, MnO4-, SO42-, Cr2O72-. При реакциях окисления-восстановления электроны не берутся откуда-то со стороны, а только переходят от одних атомов или ионов к другим, поэтому число электронов, принятых окислителем, равно числу электронов, отданных восстановителем. При составлении уравнений окислительно-восстановительных реакций для того, чтобы правильно написать продукты реакции, необходимо знать свойства реагирующих веществ.Метод электронного баланса.Подбор коэф-фициентов в реакции методом электронного баланса осуществляется по следующей схеме:1) Составить схему реакцииP+HNO3→разб.
Разбавленная азотная кислота с а) неактивными металлами (Cu), б) неметаллами (P, As, S) и в) производными этих неметаллов (AsH3, PH3, As2S3) образует оксид азота (II), понижая свою степень окисления:P+HNO3→ NO +разб.
Атом элемента в своей высшей положительной степени окисления является окислителем, следовательно, окислитель N5+ + 3ē → N2+. Атом фосфора проявляет восстановительные свойства в данной реакции, отдавая электроны с последнего энергетического уровня и повышая свою степень окисления до +5. P0 – 5ē → P+5.
Следовательно, молекулярное уравнение реакции имеет следующий вид: P + HNO3 → NO + H3PO4 разб.
2) Определить величину и знак степени окисления элементов до реакции и после реакции. +5 0 +2 +5 HNO3 + P → NO + H3PO4
3) Составить электронный баланс N5+ + 3ē → N2+ 5 P0 – 5ē → P5+ 3
4) Подставить найденные коэффициенты в уравнение реакции. 5HNO3 + 3P + 2H2O → 5NO + 3H3PO4
5) Подсчитать количество атомов водорода в правой и левой части равенства и уравнять их за счет добавления молекул воды в ту часть равенства, где их недостаточно.
6) Подсчитать количество атомов кислорода.
При правильно написанном и решенном уравнении количество атомов кислорода в правой и левой части равенства совпадает.
Пример 1. Написать уравнение окислительно-восстановительной реакции, подобрав коэффициенты к нему: FeSO4 + KMnO4 + H2SO4→ Fe2(SO4)3 + + MnSO4 + K2SO4 + H2O. Определяем степень окисления элементов до реакции и после реакции. +2 +7 +3 +2 FeSO4 + KMnO4 + H2SO4→ Fe2(SO4)3 + MnSO4 + K2SO4 + H2O. Составляем уравнения электронного баланса 2Fe2+ - 2ē → 2Fe3+ 5 Mn+7 + 5ē → Mn2+ 2Подставляем найденные коэффициенты в уравнение реакции. Подсчитываем количество групп 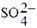 в правой части уравнения (15+2+1=18), добавляем в левую часть равенства недостающие
в правой части уравнения (15+2+1=18), добавляем в левую часть равенства недостающие 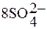 -группы в виде коэффициента при H2SO4. уравниваем число атомов водорода в правой и левой части равенства. Правильность написанного уравнения проверяем по числу атомов кислорода в правой и левой части равенства. 10FeSO4+2KMnO4+8H2SO4→5Fe2(SO4)3+2MnSO4+K2SO4+8H2O
-группы в виде коэффициента при H2SO4. уравниваем число атомов водорода в правой и левой части равенства. Правильность написанного уравнения проверяем по числу атомов кислорода в правой и левой части равенства. 10FeSO4+2KMnO4+8H2SO4→5Fe2(SO4)3+2MnSO4+K2SO4+8H2O
Ионно-электронный метод. Например, если реакция происходит с участием перманганата калия, то в реакции окислителем будут ионы MnO4-, а не ионы Mn7+, так как перманганат калия в водном растворе диссоциирует KMnO4↔K++MnO4-. При этом вещества неионного характера и недиссоциирующие изображаются в электронных уравнениях в виде молекул:NH3, CO, NO2, SiO2, P. В окислительно-восстановительных реакциях могут получаться различные продукты реакции в зависимости от характера среды – кислой, щелочной, нейтральной. Для таких реакций в молекулярной схеме необходимо указывать окислитель, восстановитель и вещество, характеризующее реакцию среды (кислоту, щелочь, воду). В этом случае в ионном уравнении необходимо руководствоваться правилами стяжения, указывать ионы, характеризующие реакцию среды: H+, OH-, H2O. Правила стяжения сводятся к следующему:
1. В кислой среде избыток ионов O+2 образует с ионами H+ молекулы воды: Изб. O2–+2H+=H2O
2. В нейтральной или щелочной среде избыток ионов O2- образует с молекулами воды гидроксид – ионы: Изб. O2–+ H2O=2OH–
3. В щелочной среде недостаток ионов O2– компенсируется двумя ионами OH-, одновременно образуется одна молекула воды: 2OH–DH2O+O2–
Разберем на конкретных примерах.
Пример 1. Составить уравнение реакции, которая протекает при пропускании сероводорода Н2S через подкисленный раствор перманганата калия КМnO4
При протекании реакции малиновая окраска исчезает и раствор мутнеет. Опыт показывает, что помутнение раствора происходит в результате образования элементарной серы из сероводорода:
H2S ® S +2H+
В этой схеме число атомов одинаково в левой и правой частях. Для уравнивания зарядов надо от левой части схемы отнять два электрона, после чего можно стрелку заменить на знак равенства: H2S – 2 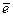 = S+2H+
= S+2H+
Эта первая полуреакция — процесс окисления восстановителя H2S. Обесцвечивание раствора связано с переходом иона МnО-4 (он имеет малиновую окраску) в ион Mn2+ (почти бесцветный и лишь при большой концентрации имеет розоватую окраску), что можно выразить схемой MnO4– ®Mn2+. Опыт показывает, что в кислом растворе кислород, входящий в состав ионов MnO-4, вместе с ионами водорода в конечном итоге образует воду. Поэтому процесс перехода записываем так: МnО-4 + 8H+ ®Мn2+ + 4Н2О. Чтобы стрелку заменить на знак равенства, надо уравнять и заряды. Поскольку исходные вещества имеют семь положительных зарядов (7+), а конечные - два положительных (2+), то для выполнения условия сохранения зарядов надо к левой части схемы прибавить пять электронов: MnO-4 + 8H++5e- = Mn2++4H2О. Это вторая полуреакция – процесс восстановления окислителя – иона MnO-4. Для составления общего (суммарного) уравнения реакции надо уравнение полуреакций почленно суммировать, предварительно уравнять число отданных и полученных электронов. В этом случае по правилам нахождения наименьшего кратного определяют соответствующие множители, на которые умножаются равенства полуреакций. Сокращенно запись проводится так: H2S – 2ē = S + 2H+ 5 MnO4– + 8H+ + 5ē = Mn2+ + 4H2O 2 5H2S + 2MnO4– + 16H+ = 5S + 10H+ + 2Mn2+ + 8H2O
Сократив на 10 Н+, окончательно получим 5Н2S + 2МnО-4 + 6Н+ =5S + 2Mn2+ + 8Н2О. Проверяем правильность составленного ионного уравнения. В примере число атомов кислорода в левой части 8, в правой 8; число зарядов в левой части (2-) + (6+) == 4+, в правой 2(2+) = 4+. Уравнение составлено правильно. Методом полуреакций составляется ионное уравнение реакции. Чтобы от ионного уравнения перейти к молекулярному, поступаем так: в левой части ионного уравнения к каждому аниону подбираем соответствующий катион, а к каждому катиону — анион. Затем такие же ионы в таком же количестве записываем и в правую часть уравнения, после чего ионы объединяем в молекулы: 5H2S + 2MnO4– + 6H+ = 5S + 2Mn2+ + 8H2O 2K+ 3SO42– = 2K+ 3SO42– 5H2S + 2KMnO4 + 3H2SO4 = 5S + 2MnSO4 + K2SO4 + 8H2O
Пример 2. Реакция среды кислая
1. Составить схему реакции K2SO3 + KMnO4 + H2SO4 ® K2SO4 + MnSO4 + H2O SO32- + MnO4- + 2H+ ® SO42- + Mn2+
Из опытных данных знаем, что окислителем является КМnO4. Ион MnO4- восстанавливается в кислой средедо Мn2+ (фиолетово-малиновая окраска иона MnO4- становится бесцветной, переходя в Мn2+ - ион), следовательно, ион SO32 - будет являться восстановителем, переходя в ион SO42-. 2. Составить электронно-ионные уравнения а) для окислителя
MnO4- + 8H+ = Mn2+ + 4H2O. Из ионной схемы видно, что, ион MnO4- – превращается в ион Мn2+, при этом освобождаются ионы О2-, которые по правилу стяжения в кислой среде связываются ионами Н+, образуя молекулыН2O. б) для восстановителя SO32- + H2O = SO42- + 2H+. Из ионной схемы видно, что ион SO32- превращается в ион SO42-. Для этого превращения необходимо добавить ион О2-, который берется из молекулы H2O (реакция протекает в водной среде), при этом освобождаются два иона Н+. 3. Подсчитать число зарядов в правой и левой части равенства, добавляя или уменьшая необходимое число электронов. Алгебраическая сумма зарядов в обеих частях равенства должна быть одинакова. MnO4- + 8H+ + 5ē = Mn2+ + 4H2O SO32- + H2O - 2ē = SO42- + 2H+ 4. Найти основные коэффициенты, т. е. коэффициенты при окислителе и восстановителе: MnO4- + 8H+ + 5ē = Mn2+ + 4H2O 2
+ SO32- + H2O - 2ē = SO42- + 2H+ 5. 5. Написать суммарное электронно-ионное уравнение, учитывая найденные коэффициенты: 2MnO4- + 16H + + 5SO32- + 5H2O =2Mn2+ + 8H2O + 5SO42- + 10H+. 6. Сократить в левой и правой части уравнения 10 Н+ и 5Н2O. Получается ионное уравнение: 2MnO4- + 6H+ + 5SO32- = 2Mn2+ + 5SO42- + 3H2O. 7. По ионному уравнению составить молекулярное уравнение реакции: 2KMnO4 + 5K2SO3 + 3H2SO4 = 2MnSO4 + 6K2SO4 + 3H2O
8. Число ионов и атомов каждого элемента в правой и левой части равенства, должно быть равно.
|
из
5.00
|
Обсуждение в статье: Важнейшие окислители и восстановители. Процессы окисления и восстановления. Составление уравнений окислительно-восстановительных реакций. Примеры? |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

