 |
Главная |
Гидролиз солей. Типы гидролиза. Степень гидролиза. Примеры?
|
из
5.00
|
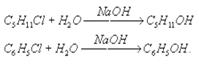 Химическое взаимодействие ионов соли с ионами воды, приводящее к образованию слабого электролита и сопровождающееся изменением рН раствора, называется гидролизом солей. Любую соль можно представить, как продукт взаимодействия кислоты и основания. Тип гидролиза соли зависит от природы основания и кислоты, образующих соль. Выделяют несколько типов гидролиза, среди которых наибольшее значение имеют: а) гидролиз по аниону. Этот тип гидролиза характерен только для неорганических и органических солей, в образовании которых участвовали слабая кислота и сильное основание, например, по аниону гидролизуются метасиликат натрия (Na2SiO3), формиат натрия (HCOONa), ацетат калия (CH3COOK), сульфит кальция (CaSO3) и т.д. Рассмотрим более подробно на примере ацетата калия (CH3COOK). Данная соль образована сильным основанием — гидроксидом калия (KOH)и слабой кислотой — уксусной (CH3COOH). Уравнение гидролиза будет выглядеть следующим образом: CH3COOK ↔ СH3COO— + K+ (диссоциация соли); СH3COO— + K+ + H2O ↔ CH3COOH + K+ + OH— (полное ионное уравнение); СH3COO— + H2O ↔ CH3COOH + OH— (сокращенное ионное уравнение); CH3COOK + H2O↔ CH3COOH + KOH (молекулярное уравнение). Наличие ионов OH— в растворе свидетельствует о щелочном характере среды. б) гидролиз по катиону. Этот тип гидролиза также характерен только для неорганических солей, в образовании которых участвовали сильная кислота и слабое основание, например, по катиону гидролизуются хлорид железа (III) (FeCl3), сульфат меди (II) (CuSO4), нитрат бериллия (Be(NO3)2) и т.д. Рассмотрим более подробно на примере нитрата бериллия (Be(NO3)2). Данная соль образована слабым основанием — гидроксидом бериллия (Be(OH)2) и сильной кислотой — азотной (HNO3). Уравнение гидролиза будет выглядеть следующим образом: Be(NO3)2 ↔ Be2+ + 2NO3— (диссоциация соли); Be2+ + 2NO3— + H2O ↔ BeOH+ + H+ + 2NO3— (полное ионное уравнение); Be2++H2O ↔ BeOH+ + H+ (сокращенное ионное уравнение); Be(NO3)2 + H2O ↔ Be(OH)NO3 + HNO3 (молекулярное уравнение). Теоретически возможна вторая ступень гидролиза: Be(OH)NO3 ↔ BeOH+ + NO3— (диссоциация соли); BeOH+ + NO3— + H2O ↔ Be(OH)2 + H+ + NO3— (полное ионное уравнение); BeOH+ + H2O ↔ Be(OH)2 + H+ (сокращенное ионное уравнение); Be(OH)NO3 + H2O ↔ Be(OH)2 + HNO3 (молекулярное уравнение). Наличие ионов H+свидетельствует о кислом характере среды. в) гидролиз и по катиону, и по аниону. Этот тип гидролиза характерен только для неорганических и органических солей, в образовании которых участвовали слабая кислота и слабое основание. Например, по катиону и аниону гидролизуются сульфит аммония (NH4SO3), сульфид железа (II) (FeS), нитрит меди (II) (Cu(NO2)2) и т.д. Рассмотрим более подробно на примере сульфида серы. Данная соль образована слабым основанием — гидроксидом железа (II) (Fe(OH)2) и слабой кислотой — сероводородной (H2S). Уравнение гидролиза будет выглядеть следующим образом: FeS ↔ Fe2+ + S2- (диссоциация соли); FeS — + H2O ↔ Fe(OH)2↓+ H2S↑ (молекулярное уравнение). Среда нейтральная. г) щелочной гидролиз. Этот тип гидролиза характерен только органических соединений.Вещество гидролизуется под действием щелочей. Рассмотрим более подробно на примере галогенпроизводных:
Химическое взаимодействие ионов соли с ионами воды, приводящее к образованию слабого электролита и сопровождающееся изменением рН раствора, называется гидролизом солей. Любую соль можно представить, как продукт взаимодействия кислоты и основания. Тип гидролиза соли зависит от природы основания и кислоты, образующих соль. Выделяют несколько типов гидролиза, среди которых наибольшее значение имеют: а) гидролиз по аниону. Этот тип гидролиза характерен только для неорганических и органических солей, в образовании которых участвовали слабая кислота и сильное основание, например, по аниону гидролизуются метасиликат натрия (Na2SiO3), формиат натрия (HCOONa), ацетат калия (CH3COOK), сульфит кальция (CaSO3) и т.д. Рассмотрим более подробно на примере ацетата калия (CH3COOK). Данная соль образована сильным основанием — гидроксидом калия (KOH)и слабой кислотой — уксусной (CH3COOH). Уравнение гидролиза будет выглядеть следующим образом: CH3COOK ↔ СH3COO— + K+ (диссоциация соли); СH3COO— + K+ + H2O ↔ CH3COOH + K+ + OH— (полное ионное уравнение); СH3COO— + H2O ↔ CH3COOH + OH— (сокращенное ионное уравнение); CH3COOK + H2O↔ CH3COOH + KOH (молекулярное уравнение). Наличие ионов OH— в растворе свидетельствует о щелочном характере среды. б) гидролиз по катиону. Этот тип гидролиза также характерен только для неорганических солей, в образовании которых участвовали сильная кислота и слабое основание, например, по катиону гидролизуются хлорид железа (III) (FeCl3), сульфат меди (II) (CuSO4), нитрат бериллия (Be(NO3)2) и т.д. Рассмотрим более подробно на примере нитрата бериллия (Be(NO3)2). Данная соль образована слабым основанием — гидроксидом бериллия (Be(OH)2) и сильной кислотой — азотной (HNO3). Уравнение гидролиза будет выглядеть следующим образом: Be(NO3)2 ↔ Be2+ + 2NO3— (диссоциация соли); Be2+ + 2NO3— + H2O ↔ BeOH+ + H+ + 2NO3— (полное ионное уравнение); Be2++H2O ↔ BeOH+ + H+ (сокращенное ионное уравнение); Be(NO3)2 + H2O ↔ Be(OH)NO3 + HNO3 (молекулярное уравнение). Теоретически возможна вторая ступень гидролиза: Be(OH)NO3 ↔ BeOH+ + NO3— (диссоциация соли); BeOH+ + NO3— + H2O ↔ Be(OH)2 + H+ + NO3— (полное ионное уравнение); BeOH+ + H2O ↔ Be(OH)2 + H+ (сокращенное ионное уравнение); Be(OH)NO3 + H2O ↔ Be(OH)2 + HNO3 (молекулярное уравнение). Наличие ионов H+свидетельствует о кислом характере среды. в) гидролиз и по катиону, и по аниону. Этот тип гидролиза характерен только для неорганических и органических солей, в образовании которых участвовали слабая кислота и слабое основание. Например, по катиону и аниону гидролизуются сульфит аммония (NH4SO3), сульфид железа (II) (FeS), нитрит меди (II) (Cu(NO2)2) и т.д. Рассмотрим более подробно на примере сульфида серы. Данная соль образована слабым основанием — гидроксидом железа (II) (Fe(OH)2) и слабой кислотой — сероводородной (H2S). Уравнение гидролиза будет выглядеть следующим образом: FeS ↔ Fe2+ + S2- (диссоциация соли); FeS — + H2O ↔ Fe(OH)2↓+ H2S↑ (молекулярное уравнение). Среда нейтральная. г) щелочной гидролиз. Этот тип гидролиза характерен только органических соединений.Вещество гидролизуется под действием щелочей. Рассмотрим более подробно на примере галогенпроизводных:
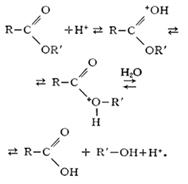
д) кислотный гидролиз. Этот тип гидролиза характерен только органических соединений. Вещество гидролизуется в присутствии сильных минеральных кислот (чаще всего соляной — HCl и серной-H2SO4). Рассмотрим более подробно на примере сложных эфиров:
 е) ферментативный гидролиз Такому типу гидролизу подвергают биополимеры, например, белки и углеводы: на одной из стадий гидролиза для более быстрого расщепления высокомолекулярных соединений в реакционную смесь вводят энзимы (ферменты).
е) ферментативный гидролиз Такому типу гидролизу подвергают биополимеры, например, белки и углеводы: на одной из стадий гидролиза для более быстрого расщепления высокомолекулярных соединений в реакционную смесь вводят энзимы (ферменты).
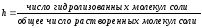 Степень гидролиза соли (h) – отношение количества соли, подвергшейся гидролизу, к общему количеству соли в растворе.Степень гидролиза может быть выражена в долях от единицы или в процентах.
Степень гидролиза соли (h) – отношение количества соли, подвергшейся гидролизу, к общему количеству соли в растворе.Степень гидролиза может быть выражена в долях от единицы или в процентах.
Основные факторы, влияющие на степень гидролиза соли – природа соли, концентрация соли, температура, добавление кислоты, щелочи или других солей. Влияние природы соли на степень ее гидролиза определяется тем, что чем более слабым электролитом (основанием или кислотой) образована данная соль, тем в большей степени она подвержена гидролизу.
|
из
5.00
|
Обсуждение в статье: Гидролиз солей. Типы гидролиза. Степень гидролиза. Примеры? |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

