 |
Главная |
Последовательность разрядки ионов на электродах. Электрохимический ряд напряжения металлов.
|
из
5.00
|
ПРАВИЛА ПОСЛЕДОВАТЕЛЬНОСТИ РАЗРЯДА ИОНОВ ПРИ ЭЛЕКТРОЛИЗЕ ВОДНЫХ РАСТВОРОВ I. Катодные процессы. На катоде могут происходить следующие конкурирующие процессы восстановления катионов металлов и/или воды:
1. Если металл находится в ряду напряжений до алюминия включительно, то на катоде восстанавливается вода и выделяется Н2, а катион металла не принимает участия в процессе восстановления: 2 𝐻2𝑂+2𝑒 →𝐻2↑ +2𝑂𝐻− 2. Если металл находится в ряду напряжений после водорода, то восстанавливается катион металла: 𝑀𝑒𝑛++𝑛𝑒→𝑀𝑒
3. Если металл расположен в ряду напряжений между алюминием и водородом, то восстанавливаются одновременно и катион металла, и вода (в качестве побочного процесса): 2 𝐻2𝑂+2𝑒 →𝐻2↑ +2𝑂𝐻− 𝑀𝑒𝑛++𝑛𝑒→𝑀𝑒 4. При наличии в растворе катионов нескольких металлов в равных концентрациях в первую очередь восстанавливаются катионы того металла, у которого величина электродного потенциала больше. 5. При электролизе водных растворов кислот (рН<7) восстанавливается катион водорода: 2 𝐻++2𝑒 →𝐻2↑ II. Анодные процессы. Анодные процессы определяются составом электрода-анода. Различают аноды двух типов: нерастворимые (инертные) и растворимые А) Нерастворимые аноды изготовлены из инертных материалов: графит (С), платина (Pt) , оксид свинца (IV) PbO2, титан (Ti), золото (Au). Нерастворимый анод в процессе электролиза химически не изменяется. 1. При электролизе водных растворов бескислородных кислот на аноде окисляются кислотные остатки: Cl−, Br−, I−, S2−: 2𝐶𝑙−−2𝑒→𝐶𝑙2 (газ) 2𝐼−−2𝑒→𝐼2(тв) 2 𝐵𝑟−−2𝑒→𝐵𝑟2(ж) 𝑆2−−2𝑒→𝑆(тв) 0 2. При электролизе водных растворов кислородосодержащих кислот на аноде происходит окисление воды, а не кислотных остатков, например, 𝑆𝑂4 2−;𝑁𝑂3 −;𝑃𝑂4 3−: 2 𝐻2𝑂−4𝑒 →𝑂2↑ +4𝐻+ 3. При электролизе щелочей (pH>7) окисляется гидроксо-анион: 4 𝑂𝐻−−4𝑒 →Н2𝑂↑ +4𝐻+ Б) Растворимые аноды могут быть изготовлены из любых металлов, не относящихся к нерастворимым анодам. На поверхности растворимого анода происходит окисление металла и анод растворяется: 𝑀𝑒0−𝑛𝑒 →𝑀𝑒𝑛+ .
Можно было бы ожидать, что при разряде положительных ионов (катионов) на катоде легче всего будут разряжаться те из них, которым отвечает наибольшее значение положительного потенциала. Аналогично при переходе с анода в раствор каких-либо положительных ионов (анодное растворение вещества) легче всего в раствор будут переходить те из них, которым отвечает наибольшее значение отрицательного потенциала. Однако указанная последовательность разряда ионов и их образования на электродах часто нарушается из-за перенапряжения. Например, при электролизе кислого раствора сульфата цинка на катоде в первую очередь должны были бы разряжаться водородные ионы, а затем ионы цинка, так как потенциал Е0Н,/2Н+=0,000 в, а Е0 Zn/Zni+=—0,76 в. Но так как перенапряжение водорода на цинке очень велико (~0,70в), то фактически в указанных условиях будет выделяться и цинк. Таким образом, при электролизе на катоде легче всего будут разряжаться те ионы, для которых суммарное значение потенциала и перенапряжение наиболее велико. Перенапряжения при катодном выделении металлов ΔЕK, сравнительно невелики. Точные данные для них отсутствуют. Для ряда металлов, как-то цинк, кадмий, серебро, золото, значение ΔЕK приближается к нулю. Для железа ΔЕK =0,24 в, а для никеля ΔЕK=0,23 в. Отличается электролиз расплавов и растворов
При электролизе расплавов на катоде выделяется метал, на аноде если кислотный остаток бескислородный, то соответствующее вещество. Например при электролизе расплава хлорида натрия на катоде натрий металлический. на аноде хлор. электроды инертные-графит. При электролизе растворов солей неактивных металлов, расположенных после водорода на катоде выделяются металлы, металлы расположенные от алюминия до водорода в ряду напряжений могут выделяться и металлы и происходить восстановление воды 2Н2О+2е=Н2+2ОН- При электролизе растворов солей металлов активных от начала до алюминия на катоде образуется гидроксид соответствующего металла уравнение выше.
На аноде кислородосодержащие кислотные остатки не окисляются, остаются в растворе а окисляется вода
2Н2О+4е=О2+4Н+ на аноде будет образовываться кислота при оформлении схемы электролиза обязательно разобрать электролитическую диссоциацию взятого вещества и работать по ионам. В водных растворах электролитов происходит избирательный разряд ионов. Последовательность, в которой ионы разряжаются, определяются рядом факторов: химической природой электрода, состоянием электролита, электродным потенциалом иона. При катодном процессе необходимо принимать во внимание величину потенциала восстановления ионов водорода. Этот потенциал зависит от концентрации ионов водорода и в случае нейтральных растворов (рН = 7) имеет значение -0,41 В. Электролиз – ОВ процесс, протекающий в растворе или расплаве при прохождении постоянного электрического тока. Электролиз HCl:
К (-) 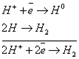 А (+)
А (+) 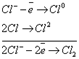
Последовательность катодных процессов. Процесс идет в направлении уменьшения потенциала.
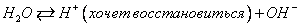
Металлы можно разбить на 3 группы: 1. 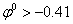 В, ВСЕГДА восстанавливается на катоде.
В, ВСЕГДА восстанавливается на катоде.
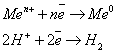 2.
2. 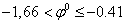 восстанавливаются вместе с водородом:
восстанавливаются вместе с водородом:
3. 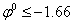 В, НИКОГДА не восстанавливаются.
В, НИКОГДА не восстанавливаются.
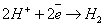
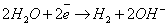 - в нейтральной или кислой средах.
- в нейтральной или кислой средах.
Последовательность анодных процессов.
А)с растворимым анодом, окисляется сам анод
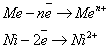
Б)угольные инертные электроды, процесс идет в порядке увеличение потенциала.
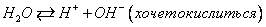
1)идет окисление бескислородных анионов кислот, за исключением Cl
2)кислородсодержащие ионы в водных растворах не окисляются (сильная ковалентная связь)
3)в случае отсутствия бескислородных ионов:
В щелочном растворе 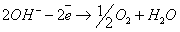
В кислой, нейтральной среде 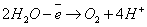
По своим химическим свойствам все металлы являются восстановителями, все они сравнительно легко отдают валентные электроны, переходят в положительно заряженные ионы, то есть окисляются. Восстановительную активность металла в химических реакциях, протекающих в водных растворах, отражает его положение в электрохимическом ряду напряжений металлов, или ряду стандартных электродных потенциалов металлов.
Электрохимический ряд напряжений металлов
Li, K, Ca, Na, Mg, Al, Zn, Cr, Fe, Pb, H2, Cu, Ag, Hg, Au
Чем левее стоит металл в ряду стандартных электродных потенциалов, тем более сильным восстановителем он является, самый сильный восстановитель – металлический литий, золото – самый слабый, и, наоборот, ион золото (III) – самый сильный окислитель, литий (I) – самый слабый. Каждый металл способен восстанавливать из солей в растворе те металлы, которые стоят в ряду напряжений после него, например, железо может вытеснять медь из растворов ее солей. Однако следует помнить, что металлы щелочных и щелочно-земельных металлов будут взаимодействовать непосредственно с водой. Металлы, стоящее в ряду напряжений левее водорода, способны вытеснять его из растворов разбавленных кислот, при этом растворяться в них. Восстановительная активность металла не всегда соответствует его положению в периодической системе, потому что при определении места металла в ряду учитывается не только его способность отдавать электроны, но и энергия, которая затрачивается на разрушение кристаллической решетки металла, а также энергия, затрачиваемая на гидратацию ионов
|
из
5.00
|
Обсуждение в статье: Последовательность разрядки ионов на электродах. Электрохимический ряд напряжения металлов. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

