 |
Главная |
Диссоциация кислот, оснований, солей. Степень и константа диссоциации. Примеры?
|
из
5.00
|
Диссоциация кислот, оснований, солей. Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода. Например, HNO3 «H+ + NO3– Многоосновные кислоты диссоциируют ступенчато. Например сероводородная кислота диссоциирует ступенчато: H2S «H+ + HS– (первая ступень) HS– «H+ + S2– (вторая ступень). Диссоциация многоосновных кислот протекает, главным образом, по первой ступени. Это объясняется тем, что энергия, которую нужно затратить для отрыва иона от нейтральной молекулы, минимальна и становится больше при диссоциации по каждой следующей ступени. Основаниями называются электролиты, диссоциирующие в растворе, которые в качестве анионов образуют только гидроксид-ионы. Например, NaOH Na+ + OH– Многокислотные основания диссоциируют ступенчато Mg(OH)2 « MgOH+ + OH– (первая ступень) MgOH+ « Mg2+ + OH– (вторая ступень) Ступенчатая диссоциация кислот и оснований объясняет образование кислых и основных солей. Существуют электролиты, которые диссоциируют одновременно как основные и как кислотные. Они называются амфотерными. H+ + RO– « ROH « R+ + OH– Амфотерность объясняется малым различием прочности связей R–H и О–Н. К амфотерным электролитам относятся вода, гидроксиды цинка, алюминия, хрома (III), олова (II, IV), свинца (II, IV) и др. Диссоциацию амфотерного гидроксида, например Sn(OH)2, можно выразить уравнением:
2H+ + SnO22– « Sn(OH)2 « Sn2+ + 2OH– ; +2H2O ¯ основные свойства; 2H+ + [Sn(OH)4]2– кислотные свойства
Солями называют электролиты, которые при диссоциации образуют катионы металлов, или комплексные катионы, и анионы кислотных остатков, или комплексные анионы. Средние соли, растворимые в воде, диссоциируют практически полностью Al2(SO4)3 « 2Al3+ + 2SO42– (NH4)2CO3 « 2NH4+ + CO32–. Кислые соли диссоциируют ступенчато, например: NaHCO3 « Na+ + HCO3– (первая ступень). Анионы кислых солей в дальнейшем диссоциируют незначительно: HCO3– « H+ + CO32– (вторая ступень). Диссоциацию основной соли можно выразить уравнением
 CuOHCl « CuOH+ + Cl– (первая ступень). CuOH+ « Cu+2 + OH– (вторая ступень) Катионы основных солей по второй ступени диссоциируют в незначительной степени. Двойные соли – это электролиты, которые при диссоциации образуют два типа катионов металла. Например KAl(SO4)2 « K+ + Al3+ + 2SO42–. Комплексные соли – это электролиты, при диссоциации которых образуются два типа ионов: простой и комплексный. Например: Na2[Zn(OH)4] «2Na+ + [Zn(OH)4)]2– Количественной характеристикой электролитической диссоциации является степень диссоциации a, равная отношению числа молекул, распавшихся на ионы (n), к общему числу растворенных молекул (N) Степень диссоциации выражается в долях единицы или процентах. По степени диссоциации все
CuOHCl « CuOH+ + Cl– (первая ступень). CuOH+ « Cu+2 + OH– (вторая ступень) Катионы основных солей по второй ступени диссоциируют в незначительной степени. Двойные соли – это электролиты, которые при диссоциации образуют два типа катионов металла. Например KAl(SO4)2 « K+ + Al3+ + 2SO42–. Комплексные соли – это электролиты, при диссоциации которых образуются два типа ионов: простой и комплексный. Например: Na2[Zn(OH)4] «2Na+ + [Zn(OH)4)]2– Количественной характеристикой электролитической диссоциации является степень диссоциации a, равная отношению числа молекул, распавшихся на ионы (n), к общему числу растворенных молекул (N) Степень диссоциации выражается в долях единицы или процентах. По степени диссоциации все
электролиты делятся на сильные (a>30%), слабые (a<3%) и средней силы (a - 3-30%). Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода (H +). Например, HCl -> H + + Cl - HNO 3 -> H + + NO 3 - Многоосновные кислоты диссоциируют ступенчато :
 Н3РО4 ↔ Н+ + Н2РО-4 (первая ступень) – дигидроортофосфат ион; Н2РО-4 ↔ Н+ + НРO2-4 (вторая ступень) – гидроортофосфат ион; НРО2-4 ↔ Н+ + PОЗ-4 (третья ступень) – ортофосфат ион. Диссоциация многоосновной кислоты протекает главным образом по первой ступени, в меньшей степени по второй и лишь в незначительной степени - по третьей. Вещества, которые в растворах или расплавах полностью или частично распадаются на ионы, называются электролитами. Степень диссоциации — величина, характеризующая состояние равновесия в реакции диссоциации в гомогенных (однородных) системах. "Степень диссоциации это есть отношения числа продиссоциируемых молекул к общему числу молекул и умноженному на 100%":
Н3РО4 ↔ Н+ + Н2РО-4 (первая ступень) – дигидроортофосфат ион; Н2РО-4 ↔ Н+ + НРO2-4 (вторая ступень) – гидроортофосфат ион; НРО2-4 ↔ Н+ + PОЗ-4 (третья ступень) – ортофосфат ион. Диссоциация многоосновной кислоты протекает главным образом по первой ступени, в меньшей степени по второй и лишь в незначительной степени - по третьей. Вещества, которые в растворах или расплавах полностью или частично распадаются на ионы, называются электролитами. Степень диссоциации — величина, характеризующая состояние равновесия в реакции диссоциации в гомогенных (однородных) системах. "Степень диссоциации это есть отношения числа продиссоциируемых молекул к общему числу молекул и умноженному на 100%":
числа распавшихся на ионы молекул к общему числу растворенных молекул
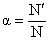 Степень диссоциации a - это отношение числа молекул, распавшихся на ионы N¢ к общему числу растворенных молекул N:
Степень диссоциации a - это отношение числа молекул, распавшихся на ионы N¢ к общему числу растворенных молекул N:
.
 Степень диссоциации выражают в процентах или в долях единицы. Если a =0, то диссоциация отсутствует и вещество не является электролитом. В случае если a =1, то электролит полностью распадается на ионы. Константа диссоциации — вид константы равновесия, которая характеризует склонность объекта диссоциировать (разделяться) обратимым образом на частицы, как например когдакомплекс распадается на составляющие молекулы, или когда соль диссоциирует в водном растворе на ионы. Константа диссоциации обычно обозначается Kd и обратна константе ассоциации. В случае с солями, константу диссоциации иногда называют константой ионизации.
Степень диссоциации выражают в процентах или в долях единицы. Если a =0, то диссоциация отсутствует и вещество не является электролитом. В случае если a =1, то электролит полностью распадается на ионы. Константа диссоциации — вид константы равновесия, которая характеризует склонность объекта диссоциировать (разделяться) обратимым образом на частицы, как например когдакомплекс распадается на составляющие молекулы, или когда соль диссоциирует в водном растворе на ионы. Константа диссоциации обычно обозначается Kd и обратна константе ассоциации. В случае с солями, константу диссоциации иногда называют константой ионизации.
Константа диссоциации
При растворении слабого электролита АК в растворе установится равновесие: КА  К+ + А- ,
К+ + А- ,
 которое количественно описывается величиной константы равновесия Кд, называемой константой диссоциации:
которое количественно описывается величиной константы равновесия Кд, называемой константой диссоциации:
Константа диссоциации характеризует способность электролита диссоциировать на ионы. Чем больше константа диссоциации, тем больше ионов в растворе слабого электролита. Например, в растворе азотистой кислоты HNO2 ионов Н+ больше, чем в растворе синильной кислоты HCN, поскольку К(HNO2) = 4,6·10- 4, а К(HCN) = 4,9·10- 10. Для слабых I-I электролитов (HCN, HNO2, CH3COOH) величина константы диссоциации Кд связана со степенью диссоциации  и концентрацией электролита c уравнением Оствальда:
и концентрацией электролита c уравнением Оствальда:
 . Для практических расчетов при условии, что
. Для практических расчетов при условии, что  <<1 используется приближенное уравнение
<<1 используется приближенное уравнение
Кд  . Поскольку процесс диссоциации слабого электролита обратим, то к нему применим принцип Ле Шателье. В частности, добавление CH3COONa к водному раствору CH3COOH вызовет подавление собственной диссоциации уксусной кислоты и уменьшение концентрации протонов. Таким образом, добавление в раствор ассоциированного электролита веществ, содержащих одноименные ионы, уменьшает его степень диссоциации. Следует отметить, что константа диссоциации слабого электролита связана с изменением энергии Гиббса в процессе диссоциации этого электролита соотношением: D GT0 = - RTlnKд. Уравнение используется для расчета констант диссоциации слабых электролитов по термодинамическим данным.
. Поскольку процесс диссоциации слабого электролита обратим, то к нему применим принцип Ле Шателье. В частности, добавление CH3COONa к водному раствору CH3COOH вызовет подавление собственной диссоциации уксусной кислоты и уменьшение концентрации протонов. Таким образом, добавление в раствор ассоциированного электролита веществ, содержащих одноименные ионы, уменьшает его степень диссоциации. Следует отметить, что константа диссоциации слабого электролита связана с изменением энергии Гиббса в процессе диссоциации этого электролита соотношением: D GT0 = - RTlnKд. Уравнение используется для расчета констант диссоциации слабых электролитов по термодинамическим данным.
|
из
5.00
|
Обсуждение в статье: Диссоциация кислот, оснований, солей. Степень и константа диссоциации. Примеры? |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

