 |
Главная |
Последовательные реакции
|
из
5.00
|
Последовательными реакциями называют связанную систему реакций, в которых продукты предыдущих стадий являются исходными веществами для последующих. В простейшем случае им отвечает схема:
k1 k2

 А В (I) ; В С (II) .
А В (I) ; В С (II) .
Поскольку обычно различные стадии последовательных реакций ( I и II ) протекают с различными скоростями , то общая скорость этого сложного процесса (скорость превращения А в С) определяется стадией, протекающей с наименьшей скоростью. Эта стадия процесса называется контролирующей или лимитирующей.
Зависимость скорости гомогенных реакций от температуры.
Как правило, скорость химических реакций с повышением температуры увеличивается. Голландским химиком Вант-Гоффом экспериментально установлено, что при увеличении температуры на каждые 10 ˚С скорость большинства реакциий возрастает в 2÷4 раза. Это правило можно записать следующим образом:
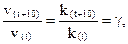
где γ – температурный коэффициент скорости реакции; γ = 2 ÷ 4.
Данную формулу можно преобразовать с учетом увеличения температуры на любую
величину:
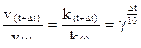 откуда:
откуда: 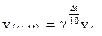
Видно, что при этом возрастает константа скорости. Вид зависимости k от Т, а также lnk от величин 1/Т (Т – абсолютная температура) представлен на рис. 1.
Шведский физико-химик С.Аррениус исследовал зависимость константы скорости реакций от температуры и показал, что она выражается эмпирическим уравнением:
k=Ае-Е/RT
где е– основание натурального логарифма; А – постоянная, характеризующая каждую конкретную реакцию (константа Аррениуса); Е – еще одна постоянная, характерная для каждой реакции; R – газовая постоянная, Т – абсолютная температура в кельвинах. В логарифмической форме уравнение , называемое уравнением Аррениуса, приобретает вид:
lnk=lnA-E/RT
или
lgk=lgA-E/2,3RT.
В этом виде уравнение Аррениуса используется наиболее часто. При этом константы А и Е, характеризующие конкретную реакцию, находят графически по экспериментальной прямой, аналогичной прямой рис. 1 б. Ее пересечение с осью у определяет значение lnA, а тангенс угла наклона равен – E/R. Чем больше значение Е, тем меньше величина k, т.е. тем меньше скорость реакции, а чем больше значение А, тем больше k и скорость реакции.
Если для двух значений Т определить константы скорости, то по можно вычислить значение Е:
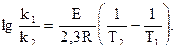

 а б
а б
k lnk
lnA
tgα = − E/R
α
T, K 1/T, K-1
Рис. 1. Зависимости константы скорости реакции k
от температуры Т (а) и lnk от 1/Т (б)
Кинетические теории химических реакций
Теория соударений
Для объяснения зависимости скорости химических реакций от концентраций реагентов и температуры была создана на основе кинетической теории газов теория соударений. По этой теории в смеси двух газообразных веществ А и В их молекулы должны столкнуться, чтобы между ними произошла химическая реакция. Было теоретически доказано, что частота столкновений Z пропорциональна произведению концентраций А и В:
Z 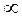 c(A)c(B).
c(A)c(B).
Если бы каждое соударение приводило к химическому превращению, то скорость реакции была бы равна частоте соударений. Теоретические вычисления этой частоты дают значение k≈1011 моль-1·л·с-1, т.е. мгновенное протекание реакции. Причина того, что большинство реакций протекает нaмного медленнее в следующем: только малая доля всех соударений заканчивается химическим превращением.
Анализ уравнения Аррениуса показывает, что его постоянная Е имеет размерность энергии. Поэтому постоянную Е называют энергией активации (Еа). Было установлено, что Еа – энергия, которой должны обладать молекулы, чтобы соударение между ними было эффективным. Экспоненциальный множитель уравнения Аррениуса exp(-E/RT) был и в теоретическом выражении, полученном Максвеллом и Больцманом в рамках кинетической теории газов, для доли молекул, обладающих повышенной энергией. На рис.2 представлены кривые распределения молекул газа по кинетической энергии при двух разных температурах. В этом графике площадь между каждой кривой и осью абсцисс пропорциональна всему количеству молекул газа. Заштрихованная площадь соответствует доле частиц, обладающих повышенной энергией (≥Е),которая в выводе Максвелла и Больцмана приблизительно определяется определяется значением exp(-E/RT). При этом, если с увеличением Т (Т2>Т1) средняя энергия молекул растет пропорционально температуре, то доля молекул с высокими значениями энергии растет быстрее за счет уменьшения доли молекул с малыми значениями энергии. Именно этим объясняется температурная зависимость скорости химических реакций (4.13). Частицы с энергией ≥Е называют активными, и только они вступают в химическое взаимодействие.



Т2
Т1
Энергия молекул х
Е
Доля молекул
с энергией ≥Е


Рис.2. Распределение молекул газа по энергиям.
Величины k и А уравнения Аррениуса оказываются одной размерности, т.е. А тоже константа скорости и отражает частоту столкновений частиц. Расчетная частота столкновений молекул газа обычно больше, чем А, определенное по экспериментальным данным. Возможное объяснение этого состоит в том, что эффективными являются не только соударения частиц с достаточной энергией, но и необходимо еще, чтобы они были соответственно сориентированы в пространстве по отношению друг к другу. Иными словами, множитель А должен включать в себя наряду с Z стерический фактор P (имеющий значение от 0 до 1), соответствующий той части сталкивающихся частиц, которые имеют необходимую взаимную ориентацию (А=РZ). Поэтому считают, что множитель А представляет собой частоту соударений активных частиц, ориентированных определенным образом.
Итак, теория бинарных соударений утверждает, что для химического превращения взаимодействующие частицы должны: I. столкнуться; II. иметь благоприятную взаимную ориентацию; III. обладать достаточной энергией. В рамках этой теории уравнение Аррениуса выведено теоретически.
Теория переходного состояния
Эта теория рассматривает процесс соударения частиц в деталях. По ней в момент соударения частиц они сближаются и между их электронными облаками нарастает взаимное отталкивание. Скорость движения частиц при этом уменьшается, а кинетическая энергия переходит в потенциальную. Если кинетическая энергия частиц была недостаточной, то они остановятся раньше, чем их электронные облака перекроются, и тогда частицы, не взаимодействуя друг с другом химически, расходятся. Если сталкиваются две активные частицы (с энергией ≥Е (рис. 2.)), то они могут преодолеть отталкивание между электронными облаками и близко подойти друг к другу. В результате перекрывания их электронных облаков создаются условия для перераспределения электронов с разрывом старых химических связей и образованием новых, т.е. условия для протекания химической реакции.
В качестве примера на рис.3 показано изменение потенциальной энергии одного эффективного соударения метильного радикала и молекулы хлороводорода:
СН3• + НCl → CH4 + Cl• .
Ось абсцисс диаграммы – это координата реакции r, показывающая степень развития процесса взаимодействия частиц от начального состояния до продуктов.
 | |||
| |||
Рис. 3. Диаграмма потенциальной энергии для единичного
столкновения реагентов Р: АК – активированный
комплекс; П – продукты
После столкновения частиц их потенциальная энергия возрастает до максимума, которому соответствует образование, состоящее из атомных ядер и связывающих электронов и называемое активированным комплексом. В таком комплексе начинают образовываться новые связи с одновременным разрывом старых связей (т.е. перераспределяются электроны между атомами); в нем как бы объединены «полуразрушенные» частицы реагентов и «полуобразовавшиеся» частицы продуктов.
Активированный комплекс (АК) для рассмотренной реакции можно представить следующим образом: [Н3С···Н···Сl ]. В общем виде взаимодействие молекул А2 и В2 будет протекать по уравнению:
реагенты активированный продукты
(начальное состояние) комплекс (конечное состояние)
Разность потенциальной энергии активированного комплекса и реагентов называют энергией активации ЕА.
Если в реакции будет участвовать по одному молю частиц реагентов, то стандартным условиям будет соответствовать диаграмма, представленная на рис. 4а, которую называют энтальпийным или энергетическим профилем реакции. Она показывает соотношение между стандартными энтальпиями 1 моля реагентов, активированных комплексов и продуктов.  и
и 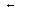 на рис.4а представляют энергии активации прямой и обратной реакций, а
на рис.4а представляют энергии активации прямой и обратной реакций, а 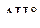 − стандартная энтальпия реакции.
− стандартная энтальпия реакции.
а) б)

 AK АК
AK АК
 |  |
Еа
 П
П
Р  Р
Р 
СН3• +HCl
 П
П
СH4+Сl•
r r
Рис. 4. Энтальпийные профили реакций
Видно, что 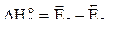 а знак
а знак 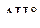 указывает, что реакция (4.18) экзотермическая (
указывает, что реакция (4.18) экзотермическая ( 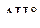 <0). В случае эндотермических реакций энтальпийный профиль будет иметь вид, подобный кривой рис.4.7б,
<0). В случае эндотермических реакций энтальпийный профиль будет иметь вид, подобный кривой рис.4.7б, 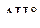 этих реакций положительно. Следует отметить, что теория переходного состояния применима как к реакциям в газах, так и к реакциям в растворах.
этих реакций положительно. Следует отметить, что теория переходного состояния применима как к реакциям в газах, так и к реакциям в растворах.
Катализ
Катализ в химической практике является одним из самых распространенных способов увеличения скорости химических реакций. Роль катализаторов при этом состоит в изменении механизмов реакций, в результате чего изменяется энергия активации и постоянная А в конкретных уравнениях Аррениуса. Установлено, что катализаторы – это вещества, изменяющие скорость реакций, участвующие в промежуточных химических взаимодействиях с компонентами реакций и восстанавливающие свой состав после каждого цикла промежуточного взаимодействия. Рассмотрим в общем виде роль катализатора в реакции:
А + В = АВ,
А + В → [А…В] → АВ.
(АК)
Пусть образование активированных комплексов (АК) происходит при большой величине энергии активации (а это означает, что скорость реакции мала). В этом случае действие катализатора реакции будет следующим. Вначале катализатор К легко вступает в реакцию с А (с малым значением Еа(1)) и образуется промежуточное вещество АК:
(1) А + К → [A…K] → AK.
(АК(1))
Затем, интермедиат АК легко взаимодействует с В (также с малым значением Еа(2)) с образованием АВ и К:
(2) АК + В → [B...A…K] → AB + K.
(АК(2))
Суммируя уравнения стадий (1) и (2), получим:
А + В = АВ,
т.е. в результате реакции катализатор К остался без изменения. На рис.5 показаны энергетические профили реакции (кривая 1) и этой же реакции в присутствии катализатора (кривая 2).


[А…В]

1 ® DEа
Еа
[А…К] [В.А.К]

А+В Еа(1) Еа(2)




 2 ®
2 ®
А+В+К АК+В АВ или АВ+К


 ΣΔΗреаг. DHр ΣΔΗпрод. ход реакции
ΣΔΗреаг. DHр ΣΔΗпрод. ход реакции
Рис. 5. Энергетические профили реакции (1)
и этой же реакции с катализатором (2)
Видно, что энергия активации реакции без катализатора Еа намного больше энергии активации первой стадии реакции с катализатором Еа(1). Энергия активации второй стадии Еа(2) также меньше, чем энергия активации реакции без катализатора. В целом, результат реакции в виде теплового эффекта один и тот же ΔΗр, что согласуется с законом Гесса, который гласит о том, что тепловые эффекты реакций не зависят от их промежуточных стадий. В случае применения катализатора реакцию можно провести с одной и той же скоростью при более низкой температуре по сравнению с реакцией без катализатора или с большей скоростью при одной и той же температуре.
Химическое равновесие
Многие реакции являются обратимыми. Химическое равновесие системы всегда имеет следующие три признака:
- система должна быть изолированной;
- скорости прямой и обратной реакций должны быть одинаковыми;
- в системе не должно происходить видимых изменений.
|
из
5.00
|
Обсуждение в статье: Последовательные реакции |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

