 |
Главная |
По методу учета степеней окисления
|
из
5.00
|
Составление уравнений по этому методу осуществляется в несколько стадий:
1. Записывают уравнение реакции со всеми участвующими в ней веществами-реагентами и продуктами – без коэффициентов.
2. Указывают степень окисления всех атомов каждого вещества.
3. Находят атомы (окислитель и восстановитель), степень окисления которых в ходе реакции изменяется.
4. Определяют числа принятых и отданных электронов в процессах восстановления и окисления. Эти числа удобно показывать над стрелками, которыми соединяют соответствующие атомы в левой и правой частях уравнения. Если в состав реагента или продукта входит несколько атомов элемента, степень окисления которых изменяется, то это учитывают умножением числа этих атомов на число соответствующих электронов.
5. Подбирают множители к числам отданных и принятых электронов (по их наименьшему общему кратному) таким образом, чтобы соответствующие произведения были равны (электронный баланс). Эти множители в виде коэффициентов ставят в обе части уравнения к продуктам и реагентам, содержащим окисляющиеся и восстанавливающиеся атомы.
6. Уравнивают числа катионов металлов в левой и правой частях уравнения.
7. Если реакция протекает в кислой среде, то уравнивают числа кислотных остатков.
8. Уравнивают числа протонов.
9. Проверяют правильность расставленных коэффициентов по равным числам атомов кислорода левой и правой частей уравнения. В тех случаях, когда у кислорода изменяется степень окисления, проверку проводят по числу атомов других элементов.
Пример 1. Найти коэффициенты несбалансированного уравнения реакции:
Zn + H3AsO3 + H2SO4 ® AsH3 + ZnSO4 + H2O . (19)
Во-первых, расставим окислительные числа ко всем атомам веществ данной реакции:
0 +1 +3 –2 +1 +6 –2 -3 +1 +2 +6 –2 +1 –2
Zn + H3AsO3 + H2SO4 ® AsH3 + ZnSO4 + H2O .
Атомы, степень окисления которых изменяется, – это атомы цинка и мышьяка. Соединим их стрелками:
- 2е
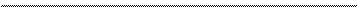
0 +3 -3 +2
Zn + H3AsO3 + H2SO4 ® AsH3 + ZnSO4 + H2O .
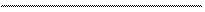
+ 6е
Атом цинка Zn(0) отдает 2 электрона и приобретает положительную степень окисления Zn(+2) в сульфате цинка; цинк - восстановитель. Ортомышьяковистая кислота (H3AsO3) - окислитель, атом мышьяка которой As(+3), принимая 6 электронов, образует арсин AsH3 , степень окисления атома мышьяка в котором -3. Уравняем числа отданных и принятых электронов: 2е × х = 6е × у. Наименьшим общим кратным чисел 2 и 6 является 6. Следовательно, множителями чисел отданных и принятых электронов будут соответственно х = 3 и у = 1, а общее число принятых электронов
( +6е ) будет равно числу отданных электронов ( -6е ).
(- 2е) × 3 = - 6е 


0 +3 -3 +2
 Zn + H3AsO3 + H2SO4 AsH3 + ZnSO4 + H2O .
Zn + H3AsO3 + H2SO4 AsH3 + ZnSO4 + H2O .
 | |||
 | |||
 (+ 6е) × 1 = +6е
(+ 6е) × 1 = +6е
Подставим найденные множители в виде коэффициентов в обе части уравнения к веществам, содержащим атомы As и Zn:
3Zn + H3AsO3 + H2SO4 ® AsH3 + 3ZnSO4 + H2O.
Так как справа оказалось три кислотных остатка, то и в левой части уравнения поставим коэффициент 3 к серной кислоте:
3Zn + H3AsO3 + 3H2SO4 ® AsH3 + 3ZnSO4 + H2O.
Далее уравняем числа атомов водорода, подставив в правую часть коэффициент 3 к воде:
3Zn + H3AsO3 + 3H2SO4 ® AsH3 + 3ZnSO4 + 3H2O.
Проверим правильность расставленных коэффициентов по количеству атомов кислорода в левой и правой частях уравнения:
3 + 3 × 4 = 3 × 4 + 3 ; 15 = 15.
Пример 2. Найти коэффициенты несбалансированного уравнения реакции:
NaBiO3 + CrCl3 + HCl ® BiCl3 + Na 2Cr 2O7 + H2O + NaCl . (20)
(+ 2е) × 3 = + 6е
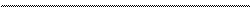
+1 +5 -2 +3 -1 +1 -1 +3 -1 +1 +6 -2 +1 –2 +1 -1
NaBiO3 + CrCl3 + HCl ® BiCl3 + Na 2Cr 2O7 + H2O + NaCl.


 (- 3е ) × 2 × 1 = - 6е
(- 3е ) × 2 × 1 = - 6е
Степень окисления изменяется у атомов висмута и хрома. Окислитель в этой реакции - висмутат натрия . В нем Bi(+5) восстанавливается до Bi(+3), принимая 2е. Восстановитель - хлорид хрома. В нем Cr(+3), отдавая 3е, окисляется до Cr(+6). Окисленные атомы хрома входят в состав дихромата натрия в количестве двух атомов, поэтому число отданных одним атомом хрома электронов надо умножить на два. Учитывая это, уравняем числа принятых (х) и отданных (у) электронов:
2е × х = 3е × 2 × у . Наименьшим общим кратным чисел 2 и 6 является 6. Следовательно, множителями чисел принятых и отданных электронов будут соответственно х = 3 и у = 1, а общее число принятых электронов (+6е) будет равно общему числу отданных электронов (-6е).
Найденные множители используем как коэффициенты: 3 для веществ, содержащих атом висмута, а 1 – для дихромата натрия. Учитывая, что в дихромате натрия два атома хрома, коэффициент 2 поставим к хлориду хрома:
3NaBiO3 + 2CrCl3 + HCl ® 3BiCl3 + Na 2Cr 2O7 + H2O + NaCl .
Так как и слева и справа оказалось по три катиона натрия, то их специально уравнивать уже не надо. Далее уравниваем числа кислотных остатков (Cl-) обеих частей уравнения: в левой части их 7, а в правой 10, поэтому поставим коэффициент 4 к хлороводороду (HCl):
3NaBiO3 + 2CrCl3 + 4HCl ® 3BiCl3 + Na 2Cr 2O7 + H2O + NaCl.
В последнем уравнении протонов (Н+) оказалось слева 4, а справа 2, поэтому в правой части поставим к Н2О коэффициент 2, тогда протонов в обеих частях уравнения окажется по 4:
3NaBiO3 + 2CrCl3 + 4HCl ® 3BiCl3 + Na 2Cr 2O7 + 2H2O + NaCl.
Остается проверить правильность расставленных коэффициентов по кислороду – его атомов слева 9 и справа 9, следовательно уравнение сбалансировано, и коэффициенты расставлены правильно.
Пример 3. Найти коэффициенты несбалансированного уравнения реакции:
Cu + HNO3 ® Cu(NO3)2 + NO + H2O . (21)
В данном случае азотная кислота выполняет функции окислителя и среды. Уравнение можно записать следующим образом:
( -2е ) × 3 = -6е
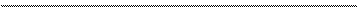
0 +1+5-2 +1+5-2 +2 +5 -2 +2-2 +1 -2
Cu + HNO3 (окисл) + HNO3 (среда) ® Cu(NO3)2 + NO + H2O.



( +3е ) × 2 = +6е
Степень окисления изменяется у меди и азота. Окислитель в этой реакции – азотная кислота. В ней N(+5), принимая 3е, восстанавливается до N(+2). Восстановитель – медь. Ее атомы Cu(0), отдавая 2е, окисляются до Cu(+2). Уравняем числа отданных и принятых электронов:
2е ×х = 3е × у . Наименьшим общим кратным чисел 2 и 3 является 6. Следовательно, множителями чисел отданных и принятых электронов будут соответственно х = 3 и у = 2, а общее число принятых электронов (+6е) будет равно общему числу отданных электронов (-6е). Найденный коэффициент 3 можно поставить в уравнение к восстановителю и его окисленной форме Cu(NO3)2 , а коэффициент 2 – к окислителю и его восстановленной форме NO:
3Cu + 2HNO3 (окисл) + HNO3 (среда) ® 3Cu(NO3)2 + 2NO + H2O .
Далее уравняем числа кислотных остатков, поставив коэффициенты 6 к азотной кислоте, выполняющей роль среды, а для уравнивания протонов поставим коэффициент 4 к молекуле воды:
3Cu + 2HNO3 (окисл) + 6HNO3 (среда) ® 3Cu(NO3)2 + 2NO + 4H2O.
Равенство чисел атомов кислорода в левой и правой частях уравнения ( по 24 ) указывает на то, что коэффициенты уравнения расставлены правильно. Окончательное уравнение реакции будет следующим:
3Cu + 8HNO3 ® 3Cu(NO3)2 + 2NO + 4H2O .
Эквивалентом окислителя или восстановителя называется частица вещества или ее доля, на которую в окислительно-восстановительной реакции приходится один присоединенный или отданный электрон. Следовательно, массу эквивалента окислителя или восстановителя в реакции ( в а.е.м. ) можно определить, разделив соответствующую молекулярную или атомную массу на число отданных или принятых электронов. Так, в реакции (3) эквивалент восстановителя – цинка будет 1/2 Zn (пол-атома цинка), а его масса и молярная масса эквивалентов (или эквивалентная масса) будут соответственно равны:
m°Э (Zn) = М (Zn) / 2 = 65 а.е.м. / 2 = 32,5 а.е.м.,
МЭ (Zn) = 32,5 г/ моль.
Эквивалент окислителя будет 1/6 H3AsO3 и, соответственно, масса и эквивалентная масса окислителя будут равны:
m°Э (H3AsO3) = М (H3AsO3) / 6 = 126 а.е.м. / 6 = 21 а.е.м.;
МЭ (H3AsO3) = 21 г/ моль.
|
из
5.00
|
Обсуждение в статье: По методу учета степеней окисления |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

