 |
Главная |
Тема: «Химическая кинетика»
|
из
5.00
|
Цель работы: изучение зависимости скорости реакции от концентрации реагента на примере окислительно-восстановительной реакции.
Химическая кинетика – раздел общей химии, изучающий скорость химических процессов и факторы, влияющие на неё.
Скоростью химической реакции называют число элементарных актов реакции, проходящих в единицу времени в единице объёма (в случае гомогенных реакций) или на единице поверхности раздела фаз (в случае гетерогенных реакций). На практике обычно скорость химической реакции определяют по изменению молярной концентрации какого-либо из исходных веществ или конечных продуктов реакции в единицу времени.
Реакции могут быть гомогенными и гетерогенными. В практике обычно скорость химической реакции определяют по изменению молярной концентрации какого-либоиз исходных веществ или конечных продуктов реакции в единицу времени (с – молярная концентрация показывает, сколько молей вещества содержится в одном литре раствора (размерность - моль/л), например, с(HCl)=0,01моль/л).
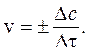
На скорость химических реакций влияют многие факторы –концентрации реагирующих веществ, давление, температура, наличие катализатора, природа реагирующих веществ, природа растворителя (для реакций в растворах).
Зависимость скорости реакции от концентрации реагентов
Закон действующих масс: при постоянной температуре скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, возведённых в степени их стехиометрических коэффициентов уравнения реакции.
Один из способов изучения влияния концентрации на скорость реакции состоит в том, чтобы определить, каким способом скорость реакции в начальный момент времени зависит от исходных концентраций. Рассмотрим этот подход на примере следующей реакции:
 .
.
Определив начальную скорость реакции в момент времени τ=0 для различных исходных концентраций  и
и  , можно получить данные, приведенные в табл. 1. Они показывают, что изменение с(
, можно получить данные, приведенные в табл. 1. Они показывают, что изменение с(  ) или с(
) или с(  ) приводит к изменению скорости реакции. Так, в результате удвоения с(
) приводит к изменению скорости реакции. Так, в результате удвоения с(  ) при постоянной с(
) при постоянной с(  ) скорость реакции тоже удваивается (опыты 1 и 2). Если с(
) скорость реакции тоже удваивается (опыты 1 и 2). Если с(  ) увеличить в четыре раза, скорость реакции тоже возрастает в четыре раза (опыты 1 и 3) и так далее. Эти результаты показывают, что скорость реакции прямо пропорциональна с(
) увеличить в четыре раза, скорость реакции тоже возрастает в четыре раза (опыты 1 и 3) и так далее. Эти результаты показывают, что скорость реакции прямо пропорциональна с(  ). Аналогичное варьирование с(
). Аналогичное варьирование с(  ) при постоянной с(
) при постоянной с(  ) оказывает на скорость точно такое же влияние. Следовательно, скорость реакции прямо пропорциональна и концентрации
) оказывает на скорость точно такое же влияние. Следовательно, скорость реакции прямо пропорциональна и концентрации  . Общую зависимость скорости от концентраций реагентов можно выразить соотношением:
. Общую зависимость скорости от концентраций реагентов можно выразить соотношением:
 (1)
(1)
Коэффициент пропорциональности k в уравнении (1) называется константой скорости, величину которой можно вычислить по данным табл.1.
Таблица 1
Данные о скорости реакции иона аммония и нитрит-иона в воде при 25 оС
| Номер опыта | Начальная концентрация  , моль/л , моль/л
| Начальная концентрация  , моль/л , моль/л
| Наблюдаемая начальная скорость, моль· л-1· с-1 |
| 1 | 0,0100 | 0,200 | 5,4·10-7 |
| 2 | 0,0200 | 0,200 | 10,8·10-7 |
| 3 | 0,0400 | 0,200 | 21,5·10-7 |
| 4 | 0,0600 | 0,200 | 32,3·10-7 |
| 5 | 0,200 | 0,0202 | 10,8·10-7 |
| 6 | 0,200 | 0,0404 | 21,6·10-7 |
| 7 | 0,200 | 0,0606 | 32,4·10-7 |
| 8 | 0,200 | 0,808 | 43,3·10-7 |
Подставив в уравнение (1) результаты опыта 1, найдем:
5,4·10-7моль/л·с=k(0,01моль/л)(0,200моль/л).
Отсюда следует, что
k = 
Уравнение, связывающее скорость реакции с концентрациями реагентов, называется уравнением скорости или кинетическим уравнением реакции. Уравнение скорости каждой химической реакции необходимо определять экспериментально; его нельзя предсказать по виду химического уравнения реакции. Приведем еще несколько примеров кинетических уравнений:
2N2O5(г)→4NO2(г)+O2(г), v=kс(N2O5);
CHCl3(г)+Cl2(г) →CCl4(г)+HCl(г), v=kс(CHCl3)c(Cl2)1/2;
H2(г)+I2(г) →2HI(г); v=kс(H2)c(I2).
Уравнения скорости для очень многих реакций имеют общий вид:
v= kcm(реагент 1)сn(реагент 2).
При фиксированных концентрациях реагентов скорость реакции пропорциональна константе скорости k. Показатели степенных членов в уравнении n и m определяют порядок реакции по каждому из реагентов, а их сумма называется полным порядком реакции. Для реакции  c
c  уравнение скорости содержит концентрацию
уравнение скорости содержит концентрацию  в первой степени. Следовательно, эта реакция имеет первый порядок по
в первой степени. Следовательно, эта реакция имеет первый порядок по  . Точно так же она имеет первый порядок по
. Точно так же она имеет первый порядок по  . Полный порядок этой реакции равен двум.
. Полный порядок этой реакции равен двум.
Очень большое число реакций имеет нулевой, первый и второй порядок. Если реакция имеет нулевой порядок по какому-нибудь реагенту, то изменение его концентрации не оказывает влияния на скорость реакции до тех пор, пока не израсходуется весь этот реагент. Если реакция имеет первый порядок по некоторому реагенту, то ее скорость прямо пропорциональна концентрации этого вещества: при удвоении его концентрации удваивается и скорость реакции и так далее. Если реакция имеет второй порядок по какому-либо реагенту, то удвоение его концентрации приводит к возрастанию скорости реакции в 22=4 раза, а увеличение концентрации в три раза вызывает возрастание скорости в 32=9 раз.
В случае гетерогенных реакций их скорость зависит от площади поверхности (дисперсности) твердых или индивидуальных жидких веществ, т.к. такие реакции протекают на границах раздела фаз.
Если процесс (реакция) протекает в одну стадию (в соответствии со стехиометрическим уравнением), то его называют простым. Кинетические уравнения простых процессов содержат одну константу скорости, а сумма степеней при концентрациях (порядок реакции) в них не превышает трёх. Сложные процессы - это совокупность простых, их кинетические уравнения содержат несколько констант скоростей реакций.
Суммарная скорость процесса определяется (лимитируется) скоростью самой медленной стадии и может быть описана кинетическим уравнением этой простой реакции. К сложным реакциям относятся: обратимые, параллельные, последовательные, сопряжённые, цепные.
Параллельные реакции.
К ним относятся реакции, одновременно протекающие в нескольких направлениях типа:

 k1 В k1 Д
k1 В k1 Д

 А или А+В
А или А+В
k2 Д k2 Е
Например, хлорат калия (бертолетова соль) КСlO3 при умеренном нагревании разлагается по схеме
 k1 2KCl + 3O2
k1 2KCl + 3O2
6KСlO3

k2 3KClO4 +KCl .
Параллельные реакции часто встречаются в органической химии и осуществляются лишь тогда, когда они термодинамически обе возможны. Преобладание той или иной из них, а потому и относительные количества получаемых продуктов, однозначно определяется соотношением констант их скоростей.
|
из
5.00
|
Обсуждение в статье: Тема: «Химическая кинетика» |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

